题目内容
10.新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池.磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行.其原因是以免磷酸亚铁锂被氧化.
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为Fe-2e-+Li+H2PO4-=LiFePO4+2H+.
(3)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为FePO4+e-+Li+=LiFePO4.
分析 (1)亚铁离子具有强还原性,制备过程中要防止亚铁化合物被氧化;
(2)可从质量守恒的角度判断气体产物;
(3)根据锂离子电池在充电过程中的阳极产物,可写出电解的阳极电极反应式,电池放电时正极反应式与电解阳极反应式相反.
解答 解:(1)亚铁离子具有强还原性,制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行,其原因是为了防止亚铁化合物被氧化,
故答案为:以免磷酸亚铁锂被氧化;
(2)将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀,阳极铁失电子生成磷酸亚铁锂,电极反应式为Fe-2e-+Li+H2PO4-=LiFePO4+2H+,
故答案为:Fe-2e-+Li+H2PO4-=LiFePO4+2H+;
(3)锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,电极反应为LiFePO4═FePO4+Li++e-,该电池放电时,正极发生还原反应,与充电时的阳极反应相反,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:FePO4+e-+Li+=LiFePO4.
点评 本题考查原电池和电解质的工作原理,题目难度中等,本题注意原电池、电解池的两极反应,把握电极反应式的书写方法,为中学电化学常考查内容.

练习册系列答案
相关题目
1.根据表中信息,下列叙述正确的是( )
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的热稳定性:H2T<H2R | |
| B. | 单质与稀盐酸反应的速率:L<Q | |
| C. | 离子半径:R2-<L2+ | |
| D. | M与T形成的化合物既能与强酸反应,又能与强碱反应 |
18.下列叙述错误的是( )
| A. | 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% | |
| B. | 地球上99%的溴蕴藏在大海中,故溴被称为“海洋元素” | |
| C. | 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 | |
| D. | 向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
15.下列说法正确的是( )
| A. | 由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 | |
| B. | 500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 已知热化学方程式:2SO2(g)+O2?(g) 2SO3(g)△H=-Q kJ/mol,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| D. | X(g)+Y(g)?Z(g)△H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大 |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| D. | 将含有0.1 mol FeCl3的饱和溶液滴入沸水中,生成的胶体中含胶体粒子的数目为0.1NA |
19.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:

流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等)等.
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.

流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.
20.表是元素周期表的一部分,针对表中的①-⑧八种元素,用元素符号或化学式回答相关问题:
(l)在这些元素中,化学性质最不活泼原子的原子结构示意图为 .
.
(2)用电子式表示①与③形成化合物的过程 .
.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,②、④的最高价氧化物对应水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)①②③④四种元素的简单离子半径由大到小的顺序是F->Na+>Mg2+>Al3+.(用离子符号和“>”表示).
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是Br2>Cl2>F2.(用化学式和“>”表示).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ | ⑧ |
 .
.(2)用电子式表示①与③形成化合物的过程
 .
.(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,②、④的最高价氧化物对应水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)①②③④四种元素的简单离子半径由大到小的顺序是F->Na+>Mg2+>Al3+.(用离子符号和“>”表示).
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是Br2>Cl2>F2.(用化学式和“>”表示).
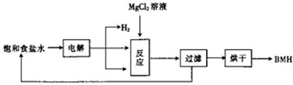 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.