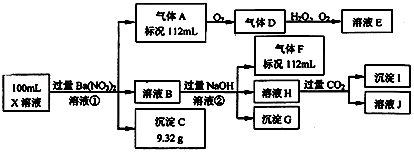
题目内容
6.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )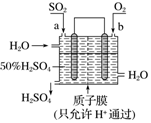
| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
分析 该原电池中,二氧化硫失电子发生氧化反应生成硫酸,所以通入二氧化硫的电极是负极、通入氧气的电极是正极,负极反应式为SO2+2H2O-2e-=SO42-+4H+,正极反应式为O2+4e-+4H+=2H2O,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.该原电池中,二氧化硫失电子发生氧化反应生成硫酸,所以通入二氧化硫的电极是负极、通入氧气的电极是正极,所以a是负极、b是正极,故A错误;
B.a是负极、b是正极,所以H+向正极b电极区域运动,故B错误;
C.左上口进入的水的量不确定,所以无法判断左下口流出的硫酸的质量分数,故C错误;
D.负极上二氧化硫失电子发生氧化反应,电极反应式为SO2+2H2O-2e-=SO42-+4H+,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,根据元素化合价变化确定正负极,知道各个电极发生的反应及电子流向,难点是电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
17.下列叙述错误的是( )
| A. | 钢铁表面发生析氢腐蚀时,钢铁表面水膜的pH增大 | |
| B. | 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少 | |
| C. | 在镀件上电镀锌,可以用锌作阳极,用硫酸锌溶液作电解质溶液 | |
| D. | 原电池的负极和电解池的阴极上都是发生失电子过程 |
18.下列关于阿佛加德罗常数的说法正确的是( )
| A. | 0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2 | |
| B. | 一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA | |
| C. | 常温下18 g铝放入足量浓硫酸中转移电子数2 NA | |
| D. | 1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA |
1.在加热条件下,将50.0g MnO2加入到100mL 12.0mol/L的浓盐酸中,经充分反应后,将剩余物质经过滤、洗涤、干燥,称得剩余固体的质量为m g,滤液(含洗涤液)体积为120mL,若向滤液(整个过程不考虑盐酸挥发)中加入足量硝酸酸化的AgNO3,生成沉淀的质量为143.5g.则下列分析正确的是( )
| A. | m=8.7 g | |
| B. | 反应过程中转移电子总数为0.1 NA | |
| C. | 反应过程中起氧化性作用的n(HCl)=0.2mol | |
| D. | 滤液中盐酸的浓度为$\frac{2}{3}$ mol/L |
10.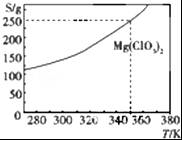 Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
 Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% | |
| D. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ |
16.下列说法中正确的是( )
| A. | 用磷酸钙陶瓷制造人体骨骼,利用的是该材料的耐高温功能 | |
| B. | 氨气具有氧化性,用浓氨水检验氯气管道是否泄漏 | |
| C. | 碳酸钠溶液显碱性,可用热的饱和碳酸钠溶液除去金属表面的油污 | |
| D. | 工业生产玻璃、水泥、陶瓷都要使用石灰石做原料 |
13.己知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1.下列判断错误的是( )
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1.下列判断错误的是( )
| A. | 等物质的量的CH4在反应①、②中转移电子数相同 | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1. | |
| C. | 4NO2(g)+2N2(g)=8NO(g);△H=+586 kJ•mol-1 | |
| D. | 若用标准状况下4.48LCH4把NO2还原为N2,整个过程中转移1.6mol电子 |