题目内容
1.在加热条件下,将50.0g MnO2加入到100mL 12.0mol/L的浓盐酸中,经充分反应后,将剩余物质经过滤、洗涤、干燥,称得剩余固体的质量为m g,滤液(含洗涤液)体积为120mL,若向滤液(整个过程不考虑盐酸挥发)中加入足量硝酸酸化的AgNO3,生成沉淀的质量为143.5g.则下列分析正确的是( )| A. | m=8.7 g | |
| B. | 反应过程中转移电子总数为0.1 NA | |
| C. | 反应过程中起氧化性作用的n(HCl)=0.2mol | |
| D. | 滤液中盐酸的浓度为$\frac{2}{3}$ mol/L |
分析 在加热的条件下发生的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,经充分反应后,将剩余物质经过滤、洗涤、干燥,称得剩余固体的质量为m g,说明浓盐酸不足已全部消耗完,估计算A时,应以浓盐酸作为计算对象,加AgNO3,生成沉淀的质量为143.5g是AgCl的质量,据此分析.
A.由盐酸的量计算消耗MnO2的质量,并求剩余固体的质量;
B.根据A消耗MnO2的质量,求转移电子数目,Mn元素由+4→+2,故没小号1molMnO2转移2mole-;
C.据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,4HCl发生价态变化的有2HCl,故起氧化性的为消耗盐酸总量的一半;
D.据c=$\frac{n}{v}$计算.
解答 解:在加热的条件下发生的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,经充分反应后,将剩余物质经过滤、洗涤、干燥,称得剩余固体的质量为m g,说明盐酸不足已全部消耗完,估计算A时,应以盐酸作为计算对象,加AgNO3,生成沉淀的质量为143.5g是AgCl的质量,根据氯原子守恒得n(AgCl)=n稀(HCl)=$\frac{143.5}{143.5}$=1mol,n(HCl)=12.0mol/L×0.1L=1.2mol,故溶解MnO2消耗浓盐酸物质的量为n浓(HCl)=n(HCl)-n(HCl)=1.2-1=0.2mol.
A.MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
87 4
m1 0.2
$\frac{87}{m1}$=$\frac{4}{0.2}$,m1=4.35g,故m=50-4.35=45.65g,故A错误;
B.MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O~2mole-
4 2
0.2 n
$\frac{4}{0.2}=\frac{2}{n}$,n=0.1mol,故B正确;
C.据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,4HCl发生价态变化的有2HCl,故起氧化性的为消耗盐酸总量的一半,n(HCl)=0.2×$\frac{1}{2}$=0.1mol,故C错误;
D.滤液中盐酸的物质的量根据氯原子守恒,即n(AgCl)=n稀(HCl)=$\frac{143.5}{143.5}$=1mol,c(HCl)=$\frac{1}{0.12}$=8.33mol/L,故D错误.
故选B.
点评 会写方程式是本题解题的关键,并且知道在化学反应计算中应该已不足的作为计算对象,本题难度中等.

| A. | ①②⑥ | B. | ③④ | C. | ①②③④ | D. | ④⑤⑥ |
| A. | SO2、H2S | B. | SO2、NO2 | C. | CO2、NH3 | D. | SO2、Cl2 |
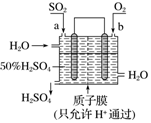
| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |