题目内容
15.某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如图: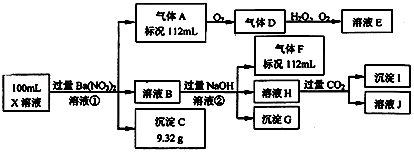
根据以上信息,回答下列问题:
(1)仅根据上述连续实验,不能确定溶液X中是否含有的阳、阴离子分别是Fe3+、Cl-(填离子符号),
能证明该阴离子是否存在的简单实验操作为取少量溶液X,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在Cl-.
(2)①中生成气体A的离子方程式为3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(3)若②中所用氢氧化钠的浓度为2mol/L,当加入l0mL时开始产生沉淀,55mL时沉淀的量达到最大值为0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60mL时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe3+)为0.1mol/L、c(Cl-)为0.4mol/L(若有些离子不存在,请填“0”).
分析 在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,根据硫酸钡的质量可以计算硫酸根离子的物质的量,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子,根据NO的体积可以计算亚铁离子的量,溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答.
解答 解:强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C9.32g为BaSO4,说明溶液中含有SO42-离子,根据硫酸钡的质量可以计算硫酸根离子的物质的量为$\frac{9.32g}{233g/mol}$=0.04mol,浓度是$\frac{0.04mol}{0.1L}$=0.4mol/L,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子,根据NO的体积可以计算亚铁离子的量,溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,112mL氨气的物质的量是0.005mol,根据氮元素守恒,溶液中含有NH4+离子物质的量是0.005mol,浓度是0.05mol/L;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)根据以上分析可知,溶液中不能确定的阳离子为Fe3+,溶液中不能确定的阴离子为Cl-,取少量溶液X,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在Cl-,
故答案为:Fe3+、Cl-;取少量溶液X,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在Cl-;
(2)中得到的气体A是NO,Fe2+离子被氧化为Fe3+离子,NO3-离子被还原为NO气体,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)根据反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,得到112mL0.005molNO,Fe2+的物质的量是0.015mol,所以原溶液中c(Fe2+)=$\frac{0.015mol}{0.1L}$=0.15mol/L,加入氢氧化钠是60ml时,沉淀的量降为0.025mol,即氢氧化铁的物质的量是0.025mol,根据铁元素守恒,所以Fe3+的物质的量是0.01mol,所以原溶液中c(Fe3+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,硫酸根离子的物质的量为$\frac{9.32g}{233g/mol}$=0.04mol,浓度是$\frac{0.04mol}{0.1L}$=0.4mol/L,NH4+离子物质的量是0.005mol,浓度是0.05mol/L,Al3+的物质的量是0.005mol,浓度是0.05mol/L,
根据反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知参加反应H+为0.005mol×4=0.02mol,加入氢氧化钠消耗H+为0.01L×2mol/L=0.02mol,故原溶液中H+为0.02mol+0.02mol=0.04mol,由于2c(Fe2+)+3c(Fe3+)+3c(Al3+)+c(NH4+)=(2×0.15+3×0.1+3×0.05+0.05)mol/L=0.8mol/L,2c(SO42-)=0.8mol/L,原溶液中含有Cl-,根据电荷守恒,c(Cl-)=c(H+)=$\frac{0.04mol}{0.1L}$=0.4mol/L,
故答案为:0.1;0.4.
点评 本题考查了常见阴阳离子的检验、无机推断,题目难度中等,注意掌握常见离子的性质及检验方法,(3)为难点、易错点,注意溶液电中性知识在化学计算中的应用方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 科学实验活动册系列答案
科学实验活动册系列答案(1)他需要选择的主要仪器有托盘天平(砝码)、500mL容量瓶、胶头滴管、药匙、烧杯和玻璃棒;玻璃棒的作用是搅拌和引流.
(2)进行实验:
①该同学通过计算需要准确称量4.0g NaOH固体;
②将称量好的NaOH固体放在小烧杯中,加适量水使其溶解并恢复至室温;
③将溶液转移至事先试过漏的仪器中;
④用适量的蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转入容器中;
⑤定容:先沿着玻璃棒向容量瓶中加入蒸馏水至距离刻度线1~2cm处,再改用胶头滴管滴加蒸馏水至凹液面与刻度线水平相切(填操作过程);
⑥振荡、摇匀、转移、装瓶.
(3)由于该同学态度不够端正,所以在实验过程中出现了一些不规范的操作,请你帮他认真分析一下这些操作对所配制溶液的浓度会造成怎样的影响,并将结果填入下表空白(填“偏高”、“偏低”或“无影响”).
| 操 作 | 溶液浓度 |
| 砝码放在左盘、NaOH固体放右盘进行称量(1g以下使用游码) | ① |
| 转移溶液时有少量液体洒落到容器外 | ② |
| 定容时俯视刻度线 | ③ |
| 摇匀后观察到液面低于刻度线,立即补充水到凹液面与刻度线水平相切 | ④ |
| A. | 用托盘天平称取3.2gNaCl固体 | B. | 用10mL量筒量取7.5mL稀盐酸 | ||
| C. | 用450mL的容量瓶配制450mL溶液 | D. | 用广泛pH试纸测得某溶液的pH为3 |
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
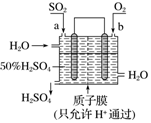
| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
| A. | 金属铜 | B. | 硝酸钾 | C. | 氯化钠溶液 | D. | 二氧化碳 |
| A. | Cl2能与水反应,在反应中Cl2只能作氧化剂 | |
| B. | 氧化性Cl2>Br2>I2,还原性Cl->Br->I- | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 氯水具有酸性,可用pH试纸测量其pH值 |