题目内容
13.己知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1.下列判断错误的是( )
| A. | 等物质的量的CH4在反应①、②中转移电子数相同 | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1. | |
| C. | 4NO2(g)+2N2(g)=8NO(g);△H=+586 kJ•mol-1 | |
| D. | 若用标准状况下4.48LCH4把NO2还原为N2,整个过程中转移1.6mol电子 |
分析 A.根据C元素的化合价变化来计算转移的电子;
B.由气态水变为液态,放出热量;
C.根据盖斯定律,①-②可得4NO2(g)+2N2(g)=8NO(g);△H=+586 kJ•mol-1;
D.根据盖斯定律,$\frac{①+②}{2}$可得CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),1molCH4反应转移8mol电子,据此计算.
解答 解:A.两个反应中,C元素的化合价均由-4价升高到+4价,则等物质的量的甲烷分别参加反应①、②,反应转移的电子数相同,故A正确;
B.由CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,水由气态变为液态,放出热量,则CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H=-Q,Q>574kJ•mol-1,所以△H<-574 kJ•mol-1,故B错误;
C.根据盖斯定律,①-②可得4NO2(g)+2N2(g)=8NO(g);△H=+586 kJ•mol-1,故C正确;
D.根据盖斯定律,$\frac{①+②}{2}$可得CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol,则1molCH4反应转移8mol电子,则用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为0.2mol×8=1.6mol,故D正确;
故选B.
点评 本题考查热化学反应及盖斯定律,明确热化学反应的关系及物质的状态、反应热的数值与物质的量的关系即可解答,题目难度不大.

练习册系列答案
相关题目
6.某同学在实验报告中记录下列数据,其中不正确的是( )
| A. | 用托盘天平称取3.2gNaCl固体 | B. | 用10mL量筒量取7.5mL稀盐酸 | ||
| C. | 用450mL的容量瓶配制450mL溶液 | D. | 用广泛pH试纸测得某溶液的pH为3 |
6.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
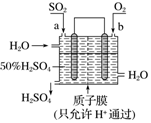

| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
1.下列物质中,属电解质的是( )
| A. | 金属铜 | B. | 硝酸钾 | C. | 氯化钠溶液 | D. | 二氧化碳 |
8.乙烷在光照的条件下与氯气混和,共可以生成几种物质( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
18.实验室里需要480mL 0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
| A. | 称取12.5g胆矾配成500mL溶液 | B. | 称取8.0g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取7.68g硫酸铜,加入500mL水 |
5.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 12g金刚石中含σ键数为4 NA | |
| B. | 1mol Na2O2固体中含离子总数为4 NA | |
| C. | ag C2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{14}$ | |
| D. | 30g甲醛中含π键数为NA |
2.下列关于卤素的说法正确的是( )
| A. | Cl2能与水反应,在反应中Cl2只能作氧化剂 | |
| B. | 氧化性Cl2>Br2>I2,还原性Cl->Br->I- | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 氯水具有酸性,可用pH试纸测量其pH值 |