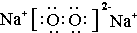题目内容
4.向等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,下列离子方程式与事实相符的是( )| A. | HCO3-+OH-→CO32-+H2O | |
| B. | Ba2++OH-+HCO3-→BaCO3↓+H2O | |
| C. | Ba2++2OH-+2HCO3-→BaCO3↓+CO32-+H2O | |
| D. | 2Ba2++3OH-+3HCO3-→2BaCO3↓+CO32-+3H2O |
分析 氢氧化钡、氯化钡中加入碳酸氢钠,碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水,生成的碳酸根离子再与钡离子反应生成碳酸钡沉淀,据此分析.
解答 解:A.等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,反应生成碳酸根离子,碳酸根离子与钡离子不共存,一定会产生沉淀,故A错误;
B.Ba2++OH-+HCO3-→BaCO3↓+H2O可以表示1mol氢氧化钡与1mol氯化钡,1mol碳酸氢钠的离子反应,故B正确;
C.若氢氧化钡物质的量为1mol,则氯化钡物质的量为1mol,加入碳酸氢钠,消耗2mol氢氧根离子生成2mol碳酸根离子,2mol碳酸根离子能够与2mol钡离子反应生成2mol碳酸钡沉淀,故C错误;
D.依据方程式可知:3molOH-对应对应1.5mol氢氧化钡,则氯化钡物质的量为1.5mol,消耗3mol碳酸氢根离子,能够生成3mol碳酸根离子,同时生成3mol碳酸钡沉淀,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查反应物用量不同的离子反应方程式的书写,明确离子反应的顺序是解题关键,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.不法商人将有毒的三聚氰胺(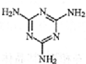 )添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )
)添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )
 )添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )
)添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )| A. | 形成的晶体熔点较高 | |
| B. | 一个分子中共含有15个σ键 | |
| C. | 属于极性分子,故极易溶于水 | |
| D. | 所有面原子采用sp2杂化,所有氮原子采用sp3杂化 |
15.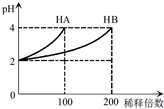 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | HA的电离方程式为HA?H++A- | |
| B. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| C. | 0.1mol/L NaB溶液中:c(H+)=c(OH-)+C(HB) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
12.下列物质的分子中,共用电子对数目最多的是( )
| A. | H2 | B. | NH3 | C. | H2O | D. | CH4 |
19.硅与某非金属元素X的化合物具有高熔点高硬度的性能,X一定不可能是( )
| A. | ⅣA族元素 | B. | ⅤA族元素 | C. | ⅥA 族元素 | D. | ⅦA族元素 |
9.能证明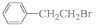 与过量NaOH醇溶液共热时发生了消去反应的是( )
与过量NaOH醇溶液共热时发生了消去反应的是( )
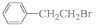 与过量NaOH醇溶液共热时发生了消去反应的是( )
与过量NaOH醇溶液共热时发生了消去反应的是( )| A. | 混合体系$\stackrel{溴水}{→}$Br2的颜色褪去 | |
| B. | 混合体系$\stackrel{足量稀HNO_{3}}{→}$ $\stackrel{AgNO_{3}溶液}{→}$淡黄色沉淀 | |
| C. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{酸性KMnO_{4}溶液}{→}$紫色褪去 | |
| D. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{Br_{2}的CCl_{4}溶液}{→}$Br2的颜色褪去 |
16.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温下,22g CO2含碳氧双键数目为2 NA | |
| B. | 12.0g NaHSO4固体中含阳离子数目为0.1 NA | |
| C. | 标准状况下,22.4 L Br2中所含分子数为NA | |
| D. | 7.8 g Na202与足量的水反应转移电子数为0.2 NA |
13.下列实验可达到实验目的是( )
| A. | 用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 用溴的四氯化碳溶液吸收SO2气体 | |
| D. | 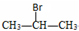 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 |