题目内容
15.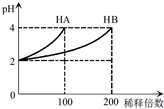 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | HA的电离方程式为HA?H++A- | |
| B. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| C. | 0.1mol/L NaB溶液中:c(H+)=c(OH-)+C(HB) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
分析 根据图象曲线变化可知,将pH=2的HA稀释100倍后,溶液的pH=4,所以HA为强酸,在溶液中完全电离;而将pH=2的HB稀释100倍后,溶液的pH<4,所以HB为弱酸,在溶液中只能部分电离.NaA为强酸强碱盐,而NaB为强碱弱酸盐,根据质子守恒等来分析.
解答 解:A、根据图象曲线变化可知,将pH=2的HA稀释100倍后,溶液的pH=4,所以HA为强酸,在溶液中能完全电离,故电离方程式为HA=H++A-,故A错误;
B、由于HA为强酸,而稀释前pH=2,故稀释前的c(HA)=0.01 mol•L-1,而HB为弱酸,故当pH=2时,所需的c(HB)大于0.01 mol•L-1,故c(HB)>c(HA)=0.01 mol•L-1,故B正确;
C、由于HB为弱酸,故NaB为强碱弱酸盐,B-在溶液中会部分水解为HB,而溶液中所有的氢离子和氢氧根均来自于水,根据质子守恒可知:c(OH-)=c(H+)+c(HB),故C错误;
D、对于NaA,有c(Na+)=c(A-),而对于NaB溶液,则有:c(Na+)=c(B-)+c(HB),故在NaA和NaB的混合溶液中,有:c(Na+)=c(A-)+c(B-)+c(HB),故D错误.
故选B.
点评 本题考查了强酸和弱酸加水稀释后pH的变化和盐溶液中离子浓度的大小比较,难度不大,应注意的盐溶液中物料守恒和质子守恒的应用.

练习册系列答案
相关题目
6.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元素,元素Y的核电荷数等于W原子的最外层电子数,元素Z的最高正化合价为+2价.下列说法正确的是( )
| A. | X、Y的单质均具有较高的熔沸点 | |
| B. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | Z、W形成的化合物中既含有离子键,又含有共价键 |
3.下列各组物质按酸、碱、盐顺序排列正确的是( )
| A. | 醋酸、纯碱、氯化钠 | B. | 硝酸、生石灰、硫酸钡 | ||
| C. | 盐酸、熟石灰、石英 | D. | 硫酸、烧碱、碳酸氢钠 |
4.向等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,下列离子方程式与事实相符的是( )
| A. | HCO3-+OH-→CO32-+H2O | |
| B. | Ba2++OH-+HCO3-→BaCO3↓+H2O | |
| C. | Ba2++2OH-+2HCO3-→BaCO3↓+CO32-+H2O | |
| D. | 2Ba2++3OH-+3HCO3-→2BaCO3↓+CO32-+3H2O |
5.纯碱被视作“碱”用于油污清洗,溶液碱性较强.下列有关分析不正确的是( )
| A. | 纯碱主要成分为Na2CO3 | B. | 热的纯碱溶液去污效果更好 | ||
| C. | 纯碱有利于油污水解 | D. | 纯碱常用于治疗胃酸过多 |
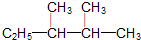 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;
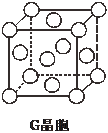 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题: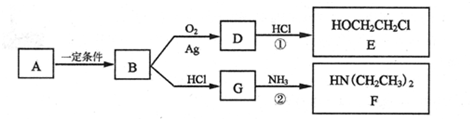
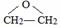 .
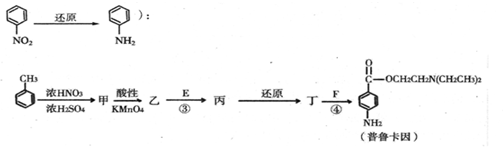
.
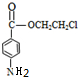 ;
; ;
; .
.