题目内容
12.下列物质的分子中,共用电子对数目最多的是( )| A. | H2 | B. | NH3 | C. | H2O | D. | CH4 |
分析 H原子形成2电子稳定结构,其它原子形成8电子稳定结构,结合原子最外层电子数分析判断共用电子对.
解答 解:A.氢气分子中H原子之间形成1对共用电子对;
B.N原子最外层有5个电子,氨气分子中N原子形成3对共用电子对;
C.O原子最外层有6个电子,水中氧原子形成2对共用电子对;
D.C最外层有4个电子,CH4中碳原子有4对共用电子对,
故选D.
点评 本题考查化学键,涉及对共价键的理解,注意根据8电子稳定结构判断,题目难度不大.

练习册系列答案
相关题目
2.第33号元素基态原子核电子占有的原子轨道数是( )
| A. | 16 | B. | 17 | C. | 18 | D. | 19 |
3.下列各组物质按酸、碱、盐顺序排列正确的是( )
| A. | 醋酸、纯碱、氯化钠 | B. | 硝酸、生石灰、硫酸钡 | ||
| C. | 盐酸、熟石灰、石英 | D. | 硫酸、烧碱、碳酸氢钠 |
17.下列试剂不会因为空气中的二氧化碳和水蒸气而变质的是( )
| A. | Na2CO3 | B. | Na2O2 | C. | CaO | D. | Ca(ClO)2 |
4.向等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,下列离子方程式与事实相符的是( )
| A. | HCO3-+OH-→CO32-+H2O | |
| B. | Ba2++OH-+HCO3-→BaCO3↓+H2O | |
| C. | Ba2++2OH-+2HCO3-→BaCO3↓+CO32-+H2O | |
| D. | 2Ba2++3OH-+3HCO3-→2BaCO3↓+CO32-+3H2O |
2.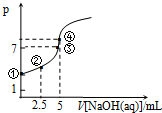 常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
 常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )| A. | 水电离出的c(OH-):①点小于 ③点 | |
| B. | 此反应的滴定实验宜选用甲基橙做指示剂 | |
| C. | ②点时c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-) | |
| D. | ④点时c(Na+)=c(N3-)+c(HN3)=$\frac{1}{15}$mol•L-1 |
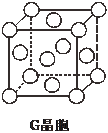 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题: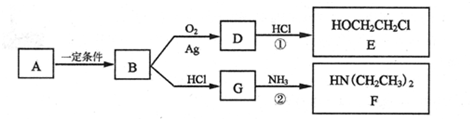
 .
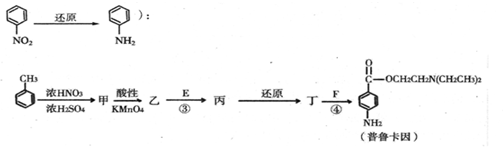
.
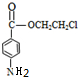 ;
; ;
;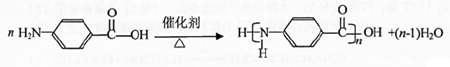 .
.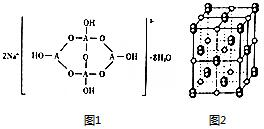 已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.
已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和. .
.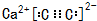 ,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).
,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).