题目内容
16.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 常温下,22g CO2含碳氧双键数目为2 NA | |
| B. | 12.0g NaHSO4固体中含阳离子数目为0.1 NA | |
| C. | 标准状况下,22.4 L Br2中所含分子数为NA | |
| D. | 7.8 g Na202与足量的水反应转移电子数为0.2 NA |
分析 A、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2mol碳氧双键来分析;
B、求出NaHSO4固体的物质的量,然后根据1molNaHSO4固体中含1mol钠离子和1molHSO4-来分析;
C、标况下溴为液态;
D、求出过氧化钠的物质的量,然后根据过氧化钠与水反应时,1mol过氧化钠转移1mol电子来分析.
解答 解:A、22g二氧化碳的物质的量为0.5mol,而1mol二氧化碳中含2mol碳氧双键,故0.5mol二氧化碳中含1mol碳氧双键即NA条,故A错误;
B、12.0gNaHSO4固体的物质的量为0.1mol,而1molNaHSO4固体中含1mol钠离子和1molHSO4-,故0.1molNaHSO4固体中含0.1NA个阳离子,故B正确;
C、标况下溴为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠与水反应时,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠和水反应时转移0.1NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元素,元素Y的核电荷数等于W原子的最外层电子数,元素Z的最高正化合价为+2价.下列说法正确的是( )
| A. | X、Y的单质均具有较高的熔沸点 | |
| B. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | Z、W形成的化合物中既含有离子键,又含有共价键 |
4.向等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,下列离子方程式与事实相符的是( )
| A. | HCO3-+OH-→CO32-+H2O | |
| B. | Ba2++OH-+HCO3-→BaCO3↓+H2O | |
| C. | Ba2++2OH-+2HCO3-→BaCO3↓+CO32-+H2O | |
| D. | 2Ba2++3OH-+3HCO3-→2BaCO3↓+CO32-+3H2O |
8.下列有关海水综合利用的说法正确的是( )
| A. | 海水提溴过程中,提取溴单质只能用有机物萃取的方法 | |
| B. | 电解饱和食盐水可制得金属钠 | |
| C. | 海水晒盐过程中主要涉及物理变化 | |
| D. | 海带提碘中,氧化过程可通入过量的氯气 |
5.纯碱被视作“碱”用于油污清洗,溶液碱性较强.下列有关分析不正确的是( )
| A. | 纯碱主要成分为Na2CO3 | B. | 热的纯碱溶液去污效果更好 | ||
| C. | 纯碱有利于油污水解 | D. | 纯碱常用于治疗胃酸过多 |
6.下列说法不正确的是( )
| A. | 能使石蕊溶液呈红色的溶液中:Na+、SO42-、Fe3+、MnO4-可以大量共存 | |
| B. | NA代表阿伏加德罗常数的数值,1 mol硫酸氢钾晶体中阳离子所带电荷总数为NA | |
| C. | 235U与238U的相互转化不是化学变化 | |
| D. | 元素O、S、P的气态氢化物热稳定性依次增强 |
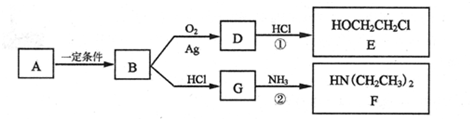
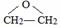 .
.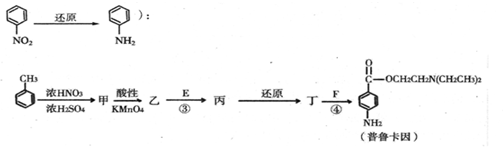
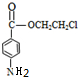 ;
; ;
;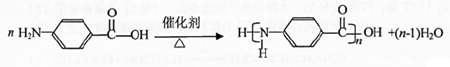 .
.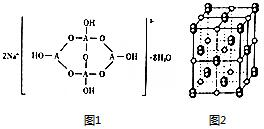 已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.
已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和. .
.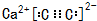 ,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).
,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).