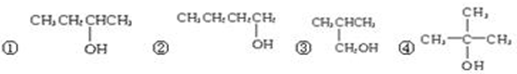
题目内容
14.不法商人将有毒的三聚氰胺(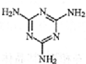 )添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )
)添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )| A. | 形成的晶体熔点较高 | |
| B. | 一个分子中共含有15个σ键 | |
| C. | 属于极性分子,故极易溶于水 | |
| D. | 所有面原子采用sp2杂化,所有氮原子采用sp3杂化 |
分析 A.分子晶体熔沸点较低;
B.单键为σ键,双键中一个是σ键、一个是π键;
C.分子结构对称,为非极性分子;
D.C=N中,C原子为sp2杂化,C=N中N原子为sp2杂化,-NH2中N原子为sp3杂化.
解答 解:A.该晶体是分子晶体,熔沸点较低,故A错误;
B.分子中含6个N-H,6个C-N,3个C=N,双键中有1个σ键,共15个σ键,故B正确;
C.分子结构对称,为非极性分子,则微溶于冷水,故C错误;
D.C=N中,C原子为sp2杂化,C=N中N原子为sp2杂化,-NH2中N原子为sp3杂化,杂化类型不同,故D错误;
故选B.
点评 本题以信息的形式考查化学键,注意把握化学键的形成规律及结构对称、杂化等即可解答,选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
4.已知X、Y是主族元素,I为电离能,单位是kJ/mol.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
2.第33号元素基态原子核电子占有的原子轨道数是( )
| A. | 16 | B. | 17 | C. | 18 | D. | 19 |
9.在硼酸[B(OH)3 ]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构.则晶体中同层分子间的主要作用力是( )
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 离子键 |
19. Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
(1)Mn元素基态原子的电子排布式为[Ar]3d54s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.其原因是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(2)氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.则氯化铁的晶体类型为分子晶体.
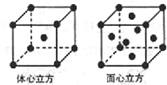
(3)金属铁的晶体在不同的温度下有两种堆积方式,如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(4)下列分子或离子中,能提供孤电对与Cu2+形成配位键的是D.(填字母,下同)
①H2O ②NH3 ③F- ④CN-
A.仅①②B.仅①②③C.仅①②④D.①②③④
(5)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液.下列叙述正确的是B.
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.[Cu(NH3)4]2+的空间构型为平面正方形.
 Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:| 元素 | Mn | Fe | |
| 电离能(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(2)氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.则氯化铁的晶体类型为分子晶体.
(3)金属铁的晶体在不同的温度下有两种堆积方式,如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(4)下列分子或离子中,能提供孤电对与Cu2+形成配位键的是D.(填字母,下同)
①H2O ②NH3 ③F- ④CN-
A.仅①②B.仅①②③C.仅①②④D.①②③④
(5)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液.下列叙述正确的是B.
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.[Cu(NH3)4]2+的空间构型为平面正方形.
6.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元素,元素Y的核电荷数等于W原子的最外层电子数,元素Z的最高正化合价为+2价.下列说法正确的是( )
| A. | X、Y的单质均具有较高的熔沸点 | |
| B. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | Z、W形成的化合物中既含有离子键,又含有共价键 |
3.下列各组物质按酸、碱、盐顺序排列正确的是( )
| A. | 醋酸、纯碱、氯化钠 | B. | 硝酸、生石灰、硫酸钡 | ||
| C. | 盐酸、熟石灰、石英 | D. | 硫酸、烧碱、碳酸氢钠 |
4.向等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,下列离子方程式与事实相符的是( )
| A. | HCO3-+OH-→CO32-+H2O | |
| B. | Ba2++OH-+HCO3-→BaCO3↓+H2O | |
| C. | Ba2++2OH-+2HCO3-→BaCO3↓+CO32-+H2O | |
| D. | 2Ba2++3OH-+3HCO3-→2BaCO3↓+CO32-+3H2O |
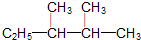 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;