题目内容
1.(1)已知反应3Cu+8HNO3═=3Cu(NO3)2+2NO↑+4H2O,氧化剂是HNO3,还原剂是Cu;Cu被氧化.Cu失电子.若有4molHNO3参加反应,有1molHNO3被还原.(2)某温度下,将Cl2通入NaOH中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:2,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为11:3;参加反应的NaOH与Cl2的物质的量之比为2:1.
分析 (1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,以此来解答;
(2)Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成NaCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比.
解答 解:(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,
则HNO3为氧化剂,Cu为还原剂,所以Cu(NO3)2为氧化产物,; 铜被氧化.铜失电子
由方程式可知,被还原的HNO3与参加反应的HNO3物质的量之比是1:4,若有4molHNO3参加反应,有 1molHNO3被还原,故答案为:HNO3;Cu;Cu;Cu;1;
(2)Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
ClO-与ClO3-的物质的量浓度之比为1:2,
则可设ClO-为1mol,ClO3-为2mol,被氧化的Cl共为3mol,
失去电子的总物质的量为1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成NaCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为11mol,
则被还原的Cl的物质的量为11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,由产物NaCl、NaClO、NaClO3的组成可知:n(Na):n(Cl)=1:1,所以参加反应的NaOH与Cl2的物质的量之比为2:1,故答案为:11:3;2:1.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,本题注意从氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度计算,注意守恒法的利用.

 口算能手系列答案
口算能手系列答案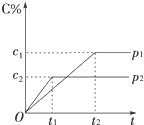 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )| A. | p1>p2 | B. | p1=p2 | C. | m+n>p+q | D. | m+n<p+q |
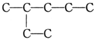
 含有的官能团有( )
含有的官能团有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
①卤素的钾盐中,最易被氧化的是氟化钾
②溴水溶有少量氯气,可以加入溴化钠在用汽油萃取的方法提纯
③溴化银具有感光性,碘化银不具有感光性
④氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成
⑤氯气跟水反应时,水既不是氧化剂也不是还原剂.
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③ |
| A. | 3NO2+H2═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2 |
| A. | C3H8中碳原子都采用的是sp3杂化 | |
| B. | O2、CO2、N2都是非极性分子 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO | |
| D. | CO的一种等电子体为NO+,它的电子式为+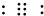 |