题目内容
15.有A、B、C、D、E五种元素,其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
分析 A原子的1s轨道上只有1个电子,则A为H元素;B是电负性最大的元素,则B为F元素;C的基态原子2p轨道中有三个未成对电子,核外电子排布为1s22s22p3,故C为N元素;E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E为Cu;D是主族元素且与E同周期,其最外层上有两个运动状态不同的电子,则D为Ca,据此解答.
解答 解:A原子的1s轨道上只有1个电子,则A为H元素;B是电负性最大的元素,则B为F元素;C的基态原子2p轨道中有三个未成对电子,核外电子排布为1s22s22p3,故C为N元素;E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E为Cu;D是主族元素且与E同周期,其最外层上有两个运动状态不同的电子,则D为Ca.
(1)E为Cu元素,核外电子排布式是:1s22s22p63s23p6sd104s1,
故答案为:1s22s22p63s23p6sd104s1;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于氧元素的,
故答案为:大;
(3)NH3分子中N原子价层电子对个数是4且含有一个孤电子对,所以N的杂化轨道类型是sp3,NH3极易溶于水的主要原因是:NH3与H2O分子间形成氢键,
故答案为:sp3;NH3与H2O分子间形成氢键;
(4)[Cu(NH3)4]2+配离子中,铜离子与氨气分子之间形成配位键,氨气分子中N原子与氢原子之间形成极性共价键,
[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形,
[Cu(NH3)4]2+中含有4个配位键、12个N-H键,1mol[Cu(NH3)4]2+中含有σ键的数目为16mol,
故答案为:①③;a;16mol.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、氢键、杂化方式、空间构型、配合物等,注意同周期元素第一电离能异常情况.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 氯原子的结构示意图 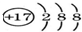 | |
| B. | 溴化钠的电子式: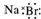 | |
| C. | 氯化镁的电子式: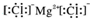 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
| A. | 氧化铝属于合金的一种,有着广泛的用途 | |
| B. | 切过肉的菜刀比切过蔬菜的菜刀更耐腐蚀 | |
| C. | 铁是地壳中含量最高的金属,也是世界上年产量最高的金属 | |
| D. | 制作沉重的机床底座时应努力实现用纯铁替代钢 |
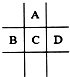 有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )
有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )| A. | A的氢化物在常温下通常为液态 | |
| B. | A的单质与C的某种化合物之间可能发生置换反应 | |
| C. | B、C、D的含氧酸酸性依次增强 | |
| D. | D的单质是制备漂白剂的重要原料 |
| A. | 磁性氧化铁溶于足量稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3(胶体)+CO32- | |
| D. | 氯气与水反应:Cl2+H2O=2H++ClO-+Cl- |
| A. | 两种元素 | B. | 互为同位素 | C. | 同种核素 | D. | 同一原子 |
| A. | Al3+、NO3- | B. | Ba2+、Al3+、Cl- | C. | Ba2+、Al3+、NO3- | D. | Ag+、Al3+、NO3- |

| A. | ①和② | B. | ⑤和⑦ | C. | ④和⑥ | D. | ③和④ |
(1)选择试剂以除去下表所列的可溶性杂质
| 杂质 | 加入的试剂 |
| 硫酸盐 | ①BaCl2 |
| MgCl2 | ②NaOH |
| CaCl2 | ③Na2CO3 |
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-,其中盐酸除去CO32-的离子方程式为CO32-+2H+=H2O+CO2↑.
(4)最后蒸发结晶操作时,玻璃棒的作用是搅拌,防止局部过热使液体飞测;,当看到有大量固体析出,或者仅余少量液体时时,应停止加热,用余热蒸干.