题目内容
19.试推断,82号元素位于周期表中的( )| A. | 第6周期、VIA族 | B. | 第7周期、ⅥA族 | C. | 第6周期、IVA族 | D. | 第7周期、IVA族 |
分析 根据各周期所含的元素种类推断,用原子序数减去各周期所含的元素种数,当结果为“0”时,为零族; 当为正数时,为周期表中从左向右数的纵行,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数.当为负数时其主族序数为8+差值.所以应熟记各周期元素的种数,即2、8、8、18、18、32、32.
解答 解:86号元素位于周期表中第6周期、0族,则82号元素位于周期表中的第6周期、IVA族,故选C.
点评 本题考查元素的推断,题目难度不大,注意原子核外电子排布与在周期表中的位置.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列关于元素周期表的叙述正确的是( )
| A. | 元素周期表中共有18个纵行,18个族,其中主族数为7个 | |
| B. | 周期表中,元素族序数等于该族元素原子的最外层电子数 | |
| C. | 周期表中,第四周期有32种元素,包括镧系元素 | |
| D. | 周期表中,ⅠA族对应第1纵行,只有一种非金属元素 |
10.下列离子方程式与所述事实相符且正确的是( )
| A. | 磁性氧化铁溶于足量稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3(胶体)+CO32- | |
| D. | 氯气与水反应:Cl2+H2O=2H++ClO-+Cl- |
7.某溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、Fe2+、NO3-、Cl-、SO42-中若干种组成,现将溶液分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成.则溶液中一定含有的离子有( )
| A. | Al3+、NO3- | B. | Ba2+、Al3+、Cl- | C. | Ba2+、Al3+、NO3- | D. | Ag+、Al3+、NO3- |
14.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 取0.5 L 0.2 mol•L-1氯化铁溶液,所得溶液含有0.1 NA个Fe3+ |
4.下列物质一定属于同系物的是( )


| A. | ①和② | B. | ⑤和⑦ | C. | ④和⑥ | D. | ③和④ |
11.某核素AZX可形成HmX型氢化物,则agHmX含有( )
| A. | $\frac{a}{A+m}$(Z+m)mol 质子 | B. | $\frac{a}{A}$(Z+m)mol 电子 | ||
| C. | $\frac{a}{A+m}$(A-Z+m)mol 中子 | D. | $\frac{a}{A}$mmolHmX |
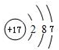 ,写出化合物E2B2的电子式
,写出化合物E2B2的电子式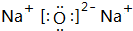 ,C在周期表中的位置第三周期VIA族.
,C在周期表中的位置第三周期VIA族. 某研究小组为了探究甲烷和氯气反应的情况,请填空:
某研究小组为了探究甲烷和氯气反应的情况,请填空: