题目内容
9.工业上根据污水中所含物质或离子的不同,有多种处理方法:| 污水中所含离子 | H+、OH- | CN- | Cu2+、Hg2+ |
| 处理方法 | 中和法 | 氧化还原法 | 沉淀法 |
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
| 物质 | Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| Ksp | 2.2×10-20 | 8.5×10 -45 | 6.3×10 -18 | 3.4×10-28 | 4×10-53 | 8×10-29 |
①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
分析 (1)中和法利用二氧化碳和碱反应的性质可除去OH-;
(2)根据反应物的物质的量关系结合质量守恒配平;
(3)①由表中数据可知Ksp(CuS)<<Ksp[Cu(OH)2],所以CuS在水中溶解度比Cu(OH)2小;
②根据n=cV计算出汞离子的物质的量,然后可计算出需要硫化钠的物质的量及质量.
解答 解:(1)pH接近7,用CO2处理,生成HCO3-,则反应的离子方程式为:OH-+CO2=HCO3-,
故答案为:OH-+CO2=HCO3-;
(2)由题意知反应物为Cl2和CN-,生成物为CO2和N2,且参加反应的Cl2与CN-的物质的量之比为5:2,根据质量守恒定律可知,反应物中还应有H2O,则反应的离子方程式为:5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+,
故答案为:5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)①由表中数据可知Ksp(CuS)<<Ksp[Cu(OH)2],所以CuS在水中溶解度比Cu(OH)2小,所以NaOH与Na2S相比,除去废水中的Cu2+效果较好的是Na2S,
故答案为:Na2S;
②10L这样的污水中含有Hg2+的质量为:10L×400mg/L=4000mg,即4g,物质的量为n(Hg2+)=$\frac{4g}{200g/mol}$=0.02mol,
反应的离子方程式为:Hg2++S2-=HgS,则n(Na2S)=n(S2-)=n(Hg2+)=0.02mol,质量为:0.02mol×78g/mol=1.56g≈1.6g,
故答案为:1.6.
点评 本题考查Ksp与溶解度的关系及污水处理,题目难度中等,根据图象判断沉淀形成的条件,充分利用图象中的信息,是解决问题的关键,试题培养了学生的分析能力及灵活应用能力.

| A. | 乙酸乙酯与乙醇的分离可用分液操作 | |
| B. | 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水 | |
| C. | 碘酒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色 | |
| D. | 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法 |
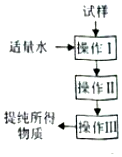 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
Ⅰ.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,
此时υ(正)< υ(逆)(填“>”“=”或“<”).
(3)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)?2N2O5(g);若已知K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1
(4)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(5)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:

一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
(6)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(7)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(8)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$ CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是,反应c中理论上原子利用率为100%.
| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | Mg粉 | Al粉 | NaOH溶液,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 盐酸浓度增加一倍,使用量减半 | |
| B. | 盐酸浓度增加一倍,使用量增加一倍 | |
| C. | 增加碳酸钠的用量 | |
| D. | 盐酸浓度不变,使用量减半 |
 某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.
某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.