题目内容
19.将盐酸滴加到碳酸钠粉末上,能使反应的最初速率加快的是( )| A. | 盐酸浓度增加一倍,使用量减半 | |
| B. | 盐酸浓度增加一倍,使用量增加一倍 | |
| C. | 增加碳酸钠的用量 | |
| D. | 盐酸浓度不变,使用量减半 |
分析 能使反应的最初速率加快,则可增大反应物的浓度、升高温度等,但碳酸钠为纯固体,改变用量对化学反应速率无影响,以此解答该题.
解答 解:A.增大浓度,可增大反应速率,故A正确;
B.盐酸浓度增加一倍,可增大反应速率,故B正确;
C.增大碳酸钠粉末的用量,则反应速率不变,故C错误;
D.盐酸浓度不变,则反应速率不变,故D错误.
故选AB.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重考查学生的分析能力,明确浓度、温度、接触面积等对反应速率的影响即可解答,难度不大.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
9.工业上根据污水中所含物质或离子的不同,有多种处理方法:
请回答下列问题:
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
如图为化学沉淀法处理污水的工艺流程示意图.
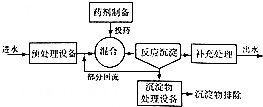
①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
| 污水中所含离子 | H+、OH- | CN- | Cu2+、Hg2+ |
| 处理方法 | 中和法 | 氧化还原法 | 沉淀法 |
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
| 物质 | Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| Ksp | 2.2×10-20 | 8.5×10 -45 | 6.3×10 -18 | 3.4×10-28 | 4×10-53 | 8×10-29 |

①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
10.表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题.
(1)元素⑦在元素周期表位置是第三周期ⅣA族.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是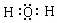 .
.
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是
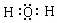 .
.(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.
14.已知有关物质的熔、沸点数据如表:
请参考上述数据填空和完成问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
4.四丁基氢氧化铵[(C4H9)4NOH]常作电子工业清洗剂.以四丁基溴化铵[(C4H9)4NBr]为原料,采用电渗析法合成(C4H9)4NOH,原理如图(c、d、e为离子交换膜).下列说法不正确的是( )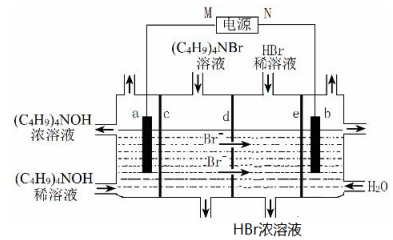

| A. | M为负极 | |
| B. | b极电极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c、e分别为阳离子交换膜和阴离子交换膜 | |
| D. | 制备 1mol(C4H9)4NOH,理论上 a极产生11.2L气体(标准状况下) |
11.下列分散系能产生“丁达尔效应”的是( )
| A. | 稀硫酸 | B. | 硫酸铜溶液 | C. | 氢氧化铁胶体 | D. | 酒精溶液 |
8.“分子马达”的关键组件三蝶烯的结构如图所示.下列说法正确的是( )
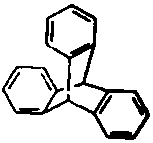

| A. | 三蝶烯是苯的同系物 | |
| B. | 三蝶烯能发生取代反应 | |
| C. | 三蝶烯的一氯代物有6种 | |
| D. | 三蝶烯分子中所有原子可能在同一平面上 |
1.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 250mL2mol•L-1的氨水中含有NH3•H2O的分子数为0.5NA | |
| B. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA | |
| C. | 1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | t℃时,pH=6 的纯水中含有OH-的个数为10-6NA |
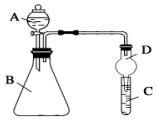 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.