题目内容
根据以下事实得出的判断一定正确的是( )
| A、HA的酸性比HB的强,则等浓度的NaA溶液 pH比NaB溶液的小 |
| B、A+和B-的电子层结构相同,则A原子的核电荷数比B原子的小 |
| C、A盐的溶解度在同温下比B盐的大,则A盐溶液的物质的量浓度比B盐溶液的大 |
| D、A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
考点:弱电解质在水溶液中的电离平衡,物质的量浓度,原子构成,氧化性、还原性强弱的比较
专题:
分析:A、从酸的浓度和酸性强弱比较PH大小;
B、从离子的核外电子排布比较核外电子层数,以此判断核电荷数关系;
C、从溶液是否饱和分析;
D、还原性与失电子的难易有关,与失电子的多少无关.
B、从离子的核外电子排布比较核外电子层数,以此判断核电荷数关系;
C、从溶液是否饱和分析;
D、还原性与失电子的难易有关,与失电子的多少无关.
解答:
解:A、HA的酸性比HB的强,根据越弱越水解,则等浓度的NaA溶液 pH比NaB溶液的小,故A正确;
B、A+和B-的电子层结构相同,则A应在B的下一周期,则A原子的核电荷数比B原子的大,故B错误;
C、虽然A盐的溶解度在同温下比B盐的大,但没有明确溶液是否饱和,故C错误;
D、还原性与失电子的难易有关,与失电子的多少无关,故D错误.
故选A.
B、A+和B-的电子层结构相同,则A应在B的下一周期,则A原子的核电荷数比B原子的大,故B错误;
C、虽然A盐的溶解度在同温下比B盐的大,但没有明确溶液是否饱和,故C错误;
D、还原性与失电子的难易有关,与失电子的多少无关,故D错误.
故选A.
点评:本题考查溶液pH的大小比较、核电荷数、浓度计算以及还原性强弱等问题,题目难度不大,做题时注意比较问题时不能以偏概全.

练习册系列答案
相关题目
过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如SARS病毒)、细菌、真菌及芽孢.过氧乙酸可由冰醋酸与过氧化氢在一定条件下作用制得,下列有关过氧乙酸的叙述中正确的是( )
| A、过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 |
| B、过氧乙酸与苯酚混合使用,可增强过氧乙酸杀菌效果 |
C、由下列过氧乙酸的制取原理可以看出,过氧乙酸是酯的同系物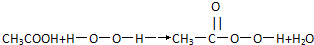 |
| D、浓过氧乙酸溶液中加入少许紫色石蕊试液,振荡后先变红,后褪色 |
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2ClO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×105 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=1.8×10-11 |
| A、相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3+Cl2+H2O=HCO-3+Cl-+HClO |
| C、向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 |
| D、向浓度均为1×10-3mol?L-1的KCl和K2CrO4混合液中滴加1×10-3mol?L-1的AgNO3溶液,CrO2-4先形成沉淀 |
①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.相同条件下,有关上述溶液的比较中,错误的是( )
| A、将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ |
| B、①④等体积混合后,溶液显碱性 |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>②>① |
化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
A、 |
B、 |
C、 |
D、 |
将10.416克纯铁丝溶于过量的盐酸中,在加热条件下,用5.05克的KNO3去氧化溶液中的Fe2+,待反应完全后,剩余Fe2+还需要24ml0.3mol/L的KMnO4溶液才能完全氧化成Fe3+,此时MnO4-转化为Mn2+,则KNO3的还原产物为( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
元素的性质与原子结构及周期表中的位置有着密切的关系.下列说法正确的是( )
| A、13C与14C互为同位素,化学性质相同,但相对原子质量一定不同 |
| B、某元素原子次外层电子数是最外层电子数的2倍,则该元素氧化物为酸性氧化物 |
| C、IA族元素与VIIA元素形成的化合物都为离子化合物 |
| D、短周期中,同周期元素的离子半径从左到右逐渐减少 |