题目内容
化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
A、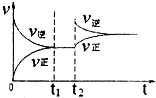 |
B、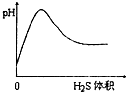 |
C、 |
D、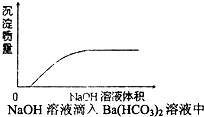 |
考点:化学反应速率与化学平衡图象的综合应用,弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A.正反应为放热反应,则升高温度,平衡逆向进行;
B.H2S气体通入氯水中,发生H2S+Cl2═2HCl+S,酸性增强,pH减小;
C.反应速率之比等于化学计量数之比;
D.NaOH溶液滴入Ba(HCO3)2溶液中,先发生NaOH+Ba(HCO3)2═BaCO3↓+NaHCO3+H2O,后发生2NaOH+Ba(HCO3)2═BaCO3↓+Na2CO3+2H2O.
B.H2S气体通入氯水中,发生H2S+Cl2═2HCl+S,酸性增强,pH减小;
C.反应速率之比等于化学计量数之比;
D.NaOH溶液滴入Ba(HCO3)2溶液中,先发生NaOH+Ba(HCO3)2═BaCO3↓+NaHCO3+H2O,后发生2NaOH+Ba(HCO3)2═BaCO3↓+Na2CO3+2H2O.
解答:
解:A.正反应为放热反应,则升高温度,平衡逆向进行,所以正逆反应速率都增大,且逆反应速率大于正反应速率,与图象一致,故A正确;
B.氯水中pH较大,H2S气体通入氯水中,发生H2S+Cl2═2HCl+S,酸性增强,pH减小,与图象矛盾,故B错误;
C.由图可知反应速率之比为(4-2):(4-0)=1:2,等于化学计量数之比,故C正确;
D.NaOH溶液滴入Ba(HCO3)2溶液中,先发生NaOH+Ba(HCO3)2═BaCO3↓+NaHCO3+H2O,后发生2NaOH+Ba(HCO3)2═BaCO3↓+Na2CO3+2H2O,显然开始就产生沉淀,且沉淀在增大,与图象矛盾,故D错误;
故选AC.
B.氯水中pH较大,H2S气体通入氯水中,发生H2S+Cl2═2HCl+S,酸性增强,pH减小,与图象矛盾,故B错误;
C.由图可知反应速率之比为(4-2):(4-0)=1:2,等于化学计量数之比,故C正确;
D.NaOH溶液滴入Ba(HCO3)2溶液中,先发生NaOH+Ba(HCO3)2═BaCO3↓+NaHCO3+H2O,后发生2NaOH+Ba(HCO3)2═BaCO3↓+Na2CO3+2H2O,显然开始就产生沉淀,且沉淀在增大,与图象矛盾,故D错误;
故选AC.
点评:本题考查化学反应速率与化学平衡的图象、化学反应及其对应的图象,明确图象中坐标的意义及点、线的意义即可解答,题目难度中等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
下列说法或化学方程式正确的是( )
A、用坩埚灼烧MgCl2?6H2O的反应式:MgCl2?6H2O
| ||||
| B、在0.1mol?L-1 Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | ||||
| C、常温下,将PH=2的稀硫酸稀释10倍,其中各离子的浓度都变为原来的十分之一 | ||||
| D、蛋白质肽链中-NH-上的氢原子与羰基上的氧原子形成氢键是蛋白质二级结构的主要依据 |
根据以下事实得出的判断一定正确的是( )
| A、HA的酸性比HB的强,则等浓度的NaA溶液 pH比NaB溶液的小 |
| B、A+和B-的电子层结构相同,则A原子的核电荷数比B原子的小 |
| C、A盐的溶解度在同温下比B盐的大,则A盐溶液的物质的量浓度比B盐溶液的大 |
| D、A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
T1温度下的部分实验数据为:下列说法不正确的是( )
T1温度下的部分实验数据为:下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500s内N2O5分解速率为2.96×10-3 mol/(L?s) |
| B、T1温度下的平衡常数为K1=125,1000s时转化率为50% |
| C、其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 |
| D、T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1>K3 |
下列离子方程式正确的是( )
| A、醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| B、铁与盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| C、氯化铁溶液和氨水反应:Fe3++3OH-→Fe(OH)3↓ |
| D、氯化铝溶液中滴入过量氢氧化钠溶液:Al3++3OH-→Al(OH)3↓ |

 (1)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同].)
(1)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同].)