题目内容
将10.416克纯铁丝溶于过量的盐酸中,在加热条件下,用5.05克的KNO3去氧化溶液中的Fe2+,待反应完全后,剩余Fe2+还需要24ml0.3mol/L的KMnO4溶液才能完全氧化成Fe3+,此时MnO4-转化为Mn2+,则KNO3的还原产物为( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
考点:氧化还原反应的计算
专题:
分析:10.41克纯铁丝的物质的量:
≈0.186mol,10.41克纯铁丝的物质的量:
≈0.186mol,铁丝溶于过量的盐酸中得到的是亚铁离子,再加入硝酸钾,硝酸会将亚铁离子氧化为铁离子,硝酸被还原,根据和硝酸参加反应的亚铁离子的量以及硝酸的量结合电子守恒计算硝酸钾的还原产物.
| 10.41g |
| 56g/mol |
| 10.41g |
| 56g/mol |
解答:
解:10.41克纯铁丝的物质的量:
≈0.186mol,所以得到亚铁离子的物质的量是0.186mol,5.05克的KNO3的物质的量是:
=0.05mol,即硝酸是0.05mol,剩余Fe2+被KMnO4溶液才能完全氧化成Fe3+的反应为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,则
MnO4-~5Fe2+
1 5
0.024L×0.3mol/L n
被硝酸氧化后,剩余的亚铁离子是5×0.024L×0.3mol/L=0.036mol,
被硝酸氧化的亚铁链子物质的量是:0.186mol-0.036mol=0.15mol,
根据电子守恒,设硝酸被还原产物中N的化合价是x,则0.15mol(3-2)=0.05mol(5-x),解得x=2,所以KNO3的还原产物为NO.
故选B.
| 10.41g |
| 56g/mol |
| 5.05g |
| 101g/mol |
MnO4-~5Fe2+
1 5
0.024L×0.3mol/L n
被硝酸氧化后,剩余的亚铁离子是5×0.024L×0.3mol/L=0.036mol,
被硝酸氧化的亚铁链子物质的量是:0.186mol-0.036mol=0.15mol,
根据电子守恒,设硝酸被还原产物中N的化合价是x,则0.15mol(3-2)=0.05mol(5-x),解得x=2,所以KNO3的还原产物为NO.
故选B.
点评:本题考查了氧化还原反应中电子守恒的计算知识,为高频考点,侧重于学生的分析能力和计算能力的考查,掌握物质性质和离子反应的电子转移是解题关键,难度不大.

练习册系列答案
相关题目
下列实验装置或操作正确的是( )
A、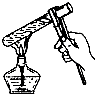 加热试管中的液体 |
B、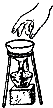 移走蒸发皿 |
C、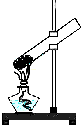 加热结晶水合物 |
D、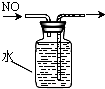 排水集气法收集NO |
根据以下事实得出的判断一定正确的是( )
| A、HA的酸性比HB的强,则等浓度的NaA溶液 pH比NaB溶液的小 |
| B、A+和B-的电子层结构相同,则A原子的核电荷数比B原子的小 |
| C、A盐的溶解度在同温下比B盐的大,则A盐溶液的物质的量浓度比B盐溶液的大 |
| D、A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
下列离子方程式正确的是( )
| A、醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| B、铁与盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| C、氯化铁溶液和氨水反应:Fe3++3OH-→Fe(OH)3↓ |
| D、氯化铝溶液中滴入过量氢氧化钠溶液:Al3++3OH-→Al(OH)3↓ |
改变外界条件可以影响化学反应速率,对反应H2(g)+I2(g)?2HI(g),其中能使活化分子百分数增加的是:①升高体系的温度 ②增加反应物浓度 ③增大气体的压强 ④使用催化剂( )
| A、①③ | B、①④ | C、②③ | D、③④ |
若NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下;22.4LH2O中共价键数目为2NA |
| B、12g金刚石的σ键数目为4 NA |
| C、16gO2与O3的混合气体中氧原子数目为NA |
| D、标准状况下1.12L乙炔中π键数目为0.05 NA |
下列有关同分异构体数目的叙述中,错误的是( )
| A、分子式为C8H10且属于芳香烃的同分异构体有4种 |
| B、C3H8光照下与氯气反应,最多能生成四种二氯代烃 |
| C、戊烷有3种同分异构体 |
| D、甲苯苯环上的一个氢原子被丙基取代,所得产物有3种 |
等体积等浓度的稀硝酸与过量的下列物质充分反应放出NO,消耗下列固体的物质的量最少的是( )
| A、FeO | B、Fe |
| C、.Cu | D、Ag |