题目内容
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2ClO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×105 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=1.8×10-11 |
| A、相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3+Cl2+H2O=HCO-3+Cl-+HClO |
| C、向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 |
| D、向浓度均为1×10-3mol?L-1的KCl和K2CrO4混合液中滴加1×10-3mol?L-1的AgNO3溶液,CrO2-4先形成沉淀 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.弱电解质的电离平衡常数越小,其离子的水解程度越大;
B.弱电解质的电离平衡常数越大,其酸性越强,所以次氯酸比碳酸氢根离子的酸性强;
C.缓冲溶液中pH=pKa+lg
;
D.混合溶液中生成氯化银需要的c(Ag+)=
,生成Ag2CrO4需要的c(Ag+)=
,需要的银离子浓度小的物质先沉淀.
B.弱电解质的电离平衡常数越大,其酸性越强,所以次氯酸比碳酸氢根离子的酸性强;
C.缓冲溶液中pH=pKa+lg
| [弱酸盐] |
| [弱酸] |
D.混合溶液中生成氯化银需要的c(Ag+)=
| Ksp(AgCl) |
| c(Cl-) |
|
解答:
解:A.次氯酸根离子的水解程度大于醋酸根离子,所以c(CH3COO-)>c(ClO-),故A错误;
B.HClO的电离平衡常数大于HCO3-,所以次氯酸的酸性大于碳酸氢根离子,则碳酸钠和少量氯水反应的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+H++ClO-,故B错误;
C.缓冲溶液中pH=pKa+lg
=4.8+lg
=5.055≈5,故C正确;
D.混合溶液中生成氯化银需要的c(Ag+)=
=
mol/L=1.8×10-7mol/L,生成Ag2CrO4需要的c(Ag+)=
=
mol/L=4.47×10-5mol/L,所以氯化银先沉淀,故D错误;
故选C.
B.HClO的电离平衡常数大于HCO3-,所以次氯酸的酸性大于碳酸氢根离子,则碳酸钠和少量氯水反应的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+H++ClO-,故B错误;
C.缓冲溶液中pH=pKa+lg
| [弱酸盐] |
| [弱酸] |
| 9 |
| 5 |
D.混合溶液中生成氯化银需要的c(Ag+)=
| Ksp(AgCl) |
| c(Cl-) |
| 1.8×10-10 |
| 1×10-3 |
|
|
故选C.
点评:本题考查弱电解质的电离、难溶电解质的溶解平衡,明确弱酸的电离平衡常数越大其酸性越强,则弱酸根离子的水解程度越小,注意ClO-、CO32-、HCO3-的水解程度大小顺序是CO32->ClO->HCO3-,难度较大.

练习册系列答案
相关题目
下列各组物质的水溶液不用试剂无法鉴别出来的是( )
| A、NaOH、AlCl3 |
| B、CuSO4、BaCl2 |
| C、NaAlO2、HCl |
| D、MgCl2、AlCl3 |
下列说法或化学方程式正确的是( )
A、用坩埚灼烧MgCl2?6H2O的反应式:MgCl2?6H2O
| ||||
| B、在0.1mol?L-1 Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | ||||
| C、常温下,将PH=2的稀硫酸稀释10倍,其中各离子的浓度都变为原来的十分之一 | ||||
| D、蛋白质肽链中-NH-上的氢原子与羰基上的氧原子形成氢键是蛋白质二级结构的主要依据 |
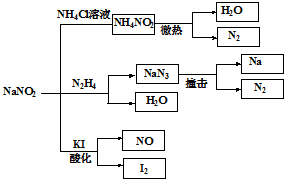 亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )
亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )| A、NH4NO2的热稳定性大于NaNO2 |
| B、NaN3分解,每产生1molN2转移6mole- |
| C、NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3-互为等电子体 |
| D、可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
根据以下事实得出的判断一定正确的是( )
| A、HA的酸性比HB的强,则等浓度的NaA溶液 pH比NaB溶液的小 |
| B、A+和B-的电子层结构相同,则A原子的核电荷数比B原子的小 |
| C、A盐的溶解度在同温下比B盐的大,则A盐溶液的物质的量浓度比B盐溶液的大 |
| D、A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
T1温度下的部分实验数据为:下列说法不正确的是( )
T1温度下的部分实验数据为:下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500s内N2O5分解速率为2.96×10-3 mol/(L?s) |
| B、T1温度下的平衡常数为K1=125,1000s时转化率为50% |
| C、其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 |
| D、T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1>K3 |
改变外界条件可以影响化学反应速率,对反应H2(g)+I2(g)?2HI(g),其中能使活化分子百分数增加的是:①升高体系的温度 ②增加反应物浓度 ③增大气体的压强 ④使用催化剂( )
| A、①③ | B、①④ | C、②③ | D、③④ |
区分晶体和非晶体的最可靠的科学方法是( )
| A、测定熔沸点的高低 |
| B、对固体进行X射线衍射 |
| C、看是否有规则的几何外形 |
| D、比较硬度 |
