题目内容
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:2SO2(g)+O2(g)
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%.
(1)5min内 v(SO3 )= mol?L-1?min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图1中画出反应速率变化图象.
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4].
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图2所示.
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵).电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol.
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: .

| V2O |
| △ |
(1)5min内 v(SO3 )=
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图1中画出反应速率变化图象.
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图2所示.
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵).电解时均用惰性电极,阳极电极反应式可表示为
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为:

考点:化学平衡的计算,电解原理
专题:
分析:(1)根据v=
计算反应速率;
(2)利用三段式法计算平衡浓度,根据平衡常数表达式计算;
(3)缩小容器体积,压强增大,正逆反应速率都增大,平衡正向移动;
(4)二氧化硫和氨水反应可生产亚硫酸铵或亚硫酸氢铵;
(5)①根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,2SO42-失电子变成S2O82-,电极反应式为:2SO42--2e-═S2O82-,
VO2+转变为VO2+,发生还原反应,应为电解池的阴极,VO2++2e-+2H+=VO2++H2O,若电解得1mol(NH4)2S2O8,则有2mol氢离子被消耗,故电解槽中氢离子浓度减小2mol;
②充电时,阳极失电子发生氧化反应:VO2++H2O-e-=VO2++2H+.
| △c |
| △t |
(2)利用三段式法计算平衡浓度,根据平衡常数表达式计算;
(3)缩小容器体积,压强增大,正逆反应速率都增大,平衡正向移动;
(4)二氧化硫和氨水反应可生产亚硫酸铵或亚硫酸氢铵;
(5)①根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,2SO42-失电子变成S2O82-,电极反应式为:2SO42--2e-═S2O82-,
VO2+转变为VO2+,发生还原反应,应为电解池的阴极,VO2++2e-+2H+=VO2++H2O,若电解得1mol(NH4)2S2O8,则有2mol氢离子被消耗,故电解槽中氢离子浓度减小2mol;
②充电时,阳极失电子发生氧化反应:VO2++H2O-e-=VO2++2H+.
解答:
解:经5min反应达平衡,SO2的平衡转化率(α)为80%,则
2SO2(g)+O2(g)?2SO3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
(1)v(SO3)=
=0.032mol/(L?min),
故答案为:0.032;
(2)K=
=
=800,
故答案为:800;
(3)缩小容器体积,压强增大,正逆反应速率都增大,平衡正向移动,图象为: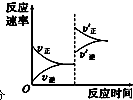 ;故答案为:
;故答案为: ;
;
(4)少量的二氧化硫和氨水反应生成亚硫酸铵,足量二氧化硫和氨水反应生产亚硫酸氢铵,
反应离子方程式为:2NH3?H2O+SO2=2NH4++SO32- 或NH3?H2O+SO2=NH4++HSO3-;
故答案为:2NH3?H2O+SO2=2NH4++SO32- 或NH3?H2O+SO2=NH4++HSO3-;
(5)①根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,2SO42-失电子变成S2O82-,电极反应式为:2SO42--2e-═S2O82-,
VO2+转变为VO2+,发生还原反应,应为电解池的阴极,VO2++2e-+2H+=VO2++H2O,若电解得1mol(NH4)2S2O8,则有2mol氢离子被消耗,
故电解槽中氢离子浓度减小2mol;
故故答案为:2SO42--2e-═S2O82-;减小;2;
②充电过程中,阳极失电子发生还原反应,电极反应式为VO2++H2O-e-═VO
+2H+,
故答案为:为VO2++H2O-e-═VO
+2H+.
2SO2(g)+O2(g)?2SO3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
(1)v(SO3)=
| 0.16mol/L |
| 5min |
故答案为:0.032;
(2)K=
| c2(SO3) |
| c2(SO2)c(O2) |
| (0.16)2 |
| (0.04)2×0.02 |
故答案为:800;
(3)缩小容器体积,压强增大,正逆反应速率都增大,平衡正向移动,图象为:
 ;故答案为:
;故答案为: ;
;(4)少量的二氧化硫和氨水反应生成亚硫酸铵,足量二氧化硫和氨水反应生产亚硫酸氢铵,
反应离子方程式为:2NH3?H2O+SO2=2NH4++SO32- 或NH3?H2O+SO2=NH4++HSO3-;
故答案为:2NH3?H2O+SO2=2NH4++SO32- 或NH3?H2O+SO2=NH4++HSO3-;
(5)①根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,2SO42-失电子变成S2O82-,电极反应式为:2SO42--2e-═S2O82-,
VO2+转变为VO2+,发生还原反应,应为电解池的阴极,VO2++2e-+2H+=VO2++H2O,若电解得1mol(NH4)2S2O8,则有2mol氢离子被消耗,
故电解槽中氢离子浓度减小2mol;
故故答案为:2SO42--2e-═S2O82-;减小;2;
②充电过程中,阳极失电子发生还原反应,电极反应式为VO2++H2O-e-═VO
+ 2 |
故答案为:为VO2++H2O-e-═VO
+ 2 |
点评:本题考查了速率的计算和平衡常数的计算影响平衡的因素及电化学知识,中等难度.注意根据题给信息书写电极反应式.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列离子在溶液中能大量共存,且通入过量SO2后无沉淀生成的一组是( )
| A、K+、Ba2+、Cl-、NO3- |
| B、K+、Na+、Br-、S2- |
| C、H+、Fe3+、I-、NO3- |
| D、Na+、Ba2+、OH-、Cl- |
下列实验装置或操作正确的是( )
A、 加热试管中的液体 |
B、 移走蒸发皿 |
C、 加热结晶水合物 |
D、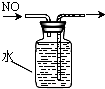 排水集气法收集NO |
根据以下事实得出的判断一定正确的是( )
| A、HA的酸性比HB的强,则等浓度的NaA溶液 pH比NaB溶液的小 |
| B、A+和B-的电子层结构相同,则A原子的核电荷数比B原子的小 |
| C、A盐的溶解度在同温下比B盐的大,则A盐溶液的物质的量浓度比B盐溶液的大 |
| D、A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
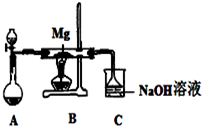 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
