题目内容
18.下列说法中正确的是( )| A. | 在标准状况下,22.4L水的质量约为18g | |
| B. | 22.4LN2含6.02×1023个氮气分子 | |
| C. | 2gH2占有的体积约为22.4L | |
| D. | 22g二氧化碳与标准状况下11.2LHCl气体含有相同的分子数 |
分析 在标准状况下,气体的摩尔体积为22.4L/mol,结合n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算.
解答 解:A.在标准状况下,水不是气体,22.4L水的物质的量不是1mol,故A不选;
B.没有说明是标准状况,无法计算,故B不选;
C.没有说明是标准状况,无法计算,故C不选;
D.22g二氧化碳的物质的量为$\frac{22g}{44g/mol}$=0.5mol,标准状况下11.2LHCl气体的物质的量为0.5mol,所以含有相同的分子数,故D选.
故选D.
点评 本题考查学生摩尔体积的概念及公式的应用,难度不大,注意把握气体摩尔体积的应用条件,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
8.用实验室制溴苯的废催化剂FeBr3作原料,制取溴的苯溶液和无水FeCl3.下列设计能达到相应实验目的是( )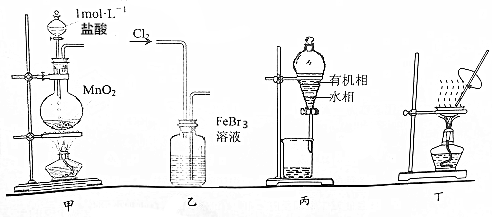

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙氧化FeBr3溶液中的溴离子 | |
| C. | 用装置丙分液时先从下口放出水相,再从上口倒出有机相 | |
| D. | 用装置丁将分液后的水相蒸发至干,再灼烧制得无水FeCl3 |
9.在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是( )
| A. | AB2 | B. | A2B | C. | AB3 | D. | A3B |
6.向下列溶液中逐滴加入NaOH溶液至过量,先有白色沉淀生成,然后沉淀又消失的是( )
| A. | CuCl2溶液 | B. | AlCl3溶液 | C. | MgCl2溶液 | D. | BaCl2溶液 |
13.下列关于著名科学家的国籍、名字和研究成果的对应关系中,正确的是( )
| A. | 英国道尔顿----提出元素概念 | |
| B. | 法国拉瓦锡----提出原子学说 | |
| C. | 俄国门捷列夫---发现元素周期律 | |
| D. | 英国波义耳----建立燃烧现象的氧化学说 |
3.下列说法中,正确的是( )
| A. | 钠和氢气分别在氯气中燃烧,都产生白色烟雾 | |
| B. | 铜丝在氯气中燃烧,生成蓝色的氯化铜 | |
| C. | 液氯和氯水中滴入硝酸银溶液均会产生白色沉淀 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液后溶液呈红色 |
10.下列反应的能量变化与其他三项不相同的是( )
| A. | 甲烷燃烧 | B. | 碳酸钙高温分解 | ||
| C. | 锌片与稀硫酸反应 | D. | 钠与冷水反应 |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,80 g SO3所占的体积约为22.4 L | |
| B. | 常温常压下,1.6 gO2和O3混合气体中质子总数为0.8NA | |
| C. | 0.1 mol甲基(-CH3)所含电子数为NA | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
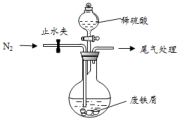 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: