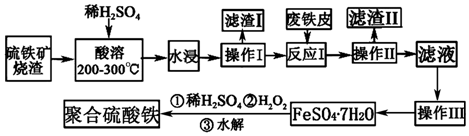
题目内容
9.在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是( )| A. | AB2 | B. | A2B | C. | AB3 | D. | A3B |
分析 根据阿伏伽德罗定律可知,相同条件下,体积与物质的量成正比,且物质的量之比等于化学计量数之比,再结合质量守恒定律来解答.
解答 解:在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X,
由相同条件下,体积与物质的量成正比,且物质的量之比等于化学计量数之比,
则反应为A2+3B2═2X,
又反应前后原子守恒,
则X的化学式为AB3,
故选C.
点评 本题考查阿伏伽德罗定律及其推论,明确体积与化学计量数的关系是解答的关键,并注意利用原子守恒来分析物质的化学式即可解答,题目难度不大.

练习册系列答案
相关题目
19. 某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.用酸式滴定管准确移取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液、待测盐酸溶液分别润洗碱式滴定管、酸式滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.就此实验完成如下填空:
(1)正确操作步骤的顺序是BDCEAF(用序号字母填写);
(2)下列可以作为本次滴定实验最佳指示剂的是C;
A.淀粉 B.石蕊 C.酚酞 D.KMnO4
(3)判断到达滴定终点的实验现象是滴入最后一滴KOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色;
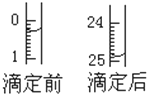
(4)如图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准KOH溶液的体积填入下表空格中.有关数据记录如下:
(5)根据上表数据,则盐酸样品的物质的量浓度 (不必化简)CHCl=$\frac{24.60×0.1}{20.00}$mol/L;
(6)下列几种情况会使测定结果偏高的是ac.
a.上述A步骤操作之前,先用待测液润洗锥形瓶
b.读数时,若滴定前仰视,滴定后俯视
c.若在滴定过程中不慎将数滴碱液滴在锥形瓶外
d.若未充分振荡,刚看到溶液变色,立刻停止滴定
f.若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸.
 某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:A.用酸式滴定管准确移取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液、待测盐酸溶液分别润洗碱式滴定管、酸式滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.就此实验完成如下填空:
(1)正确操作步骤的顺序是BDCEAF(用序号字母填写);
(2)下列可以作为本次滴定实验最佳指示剂的是C;
A.淀粉 B.石蕊 C.酚酞 D.KMnO4
(3)判断到达滴定终点的实验现象是滴入最后一滴KOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色;
(4)如图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准KOH溶液的体积填入下表空格中.有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗KOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 25.12 | 24.62 |
| 2 | 20.00 | 0.30 | 24.90 | 24.60 |
| 3 | 20.00 | 6.00 | 30.58 | 24.58 |
(6)下列几种情况会使测定结果偏高的是ac.
a.上述A步骤操作之前,先用待测液润洗锥形瓶
b.读数时,若滴定前仰视,滴定后俯视
c.若在滴定过程中不慎将数滴碱液滴在锥形瓶外
d.若未充分振荡,刚看到溶液变色,立刻停止滴定
f.若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸.
17.以NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子. | |
| B. | 1 mol Fe参与反应失去电子数目一定为2NA | |
| C. | 1 molNA被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
4.在甲烧杯中放入盐酸,乙烧杯中放入某一元酸HA,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气,则下列事实或叙述能说明一元酸HA是弱酸的是( )
| A. | 两烧杯中参加反应的锌粒等量 | |
| B. | 反应开始时产生H2的速率相等 | |
| C. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大 | |
| D. | 甲烧杯中放入锌的质量一定比乙烧杯中放入锌的质量大 |
14.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止副食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质.下列不属于抗氧化物质的是( )
| A. | 生石灰 | B. | 亚硫酸钠(Na2SO3) | C. | 铁粉 | D. | 硫酸亚铁(FeSO4) |
1.下列物质属于强电解质的是( )
| A. | Fe(OH)3 | B. | FeCl3 | C. | Al(OH)3 | D. | Fe(OH)2 |
18.下列说法中正确的是( )
| A. | 在标准状况下,22.4L水的质量约为18g | |
| B. | 22.4LN2含6.02×1023个氮气分子 | |
| C. | 2gH2占有的体积约为22.4L | |
| D. | 22g二氧化碳与标准状况下11.2LHCl气体含有相同的分子数 |
4.25℃,101k Pa时,强酸与强/碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=+57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)=8CO2 (g)+9H2O(g)△H=-5518kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)△H=-11036kJ/mol |