题目内容
16.保险粉(Na2S2O4)有极强的还原性,遇热水或潮湿空气会分解发热,但在碱性环境下较稳定.回答下列问题:(1)二氧化硫的制备
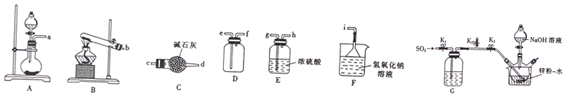
①二氧化硫的发生装置可以选择图中的A(填大写字母),反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
②欲收集一瓶干燥的二氧化硫,选择图中的装置,其接口的连接顺序为发生装置→g→h→e→f→i(e).(按气流方向,用小写字母表示)
(2)保险粉的制备
在35-45℃下,将SO2气体通入锌粉一水悬浮液中(如图),使之发生反应生成ZnS2O4;待反应完全后,移走恒温水浴装置并冷却至室温,向三颈烧瓶中加人18%的NaOH溶液,使之发生反应生成Na2S2O4和Zn(OH)2;经一系列操作后得到无水Na2S2O4样品.
①实验开始时,应先关闭止水夹K3、打开K1和K2,通入一段时间SO2,其原因是排除装置中的氧气.
②通过观察三颈烧瓶(或装置G)中通入二氧化硫导管中的气泡数,调节止水夹K1来控制SO2的流速.
③由ZnS2O4生成Na2S2O4的化学方程式为ZnS2O4+2NaOH=Na2S2O4+Zn(OH)2↓.
(3)称取2.0gNa2S2O4样品溶于冷水中,配成100mL吐溶液,取出10mL该溶液于试管中,用0.10mol/L的KMnO4溶液滴定(滴定至终点时产物为Na2SO4和MnSO4),重复上述操作2次,平均消耗溶液12.00mL.则该样品中Na2S2O4的质量分数为87%(杂质不参与反应).
分析 (1)实验室用亚硫酸钠与浓硫酸反应制备二氧化硫,选择A装置,用浓硫酸干燥二氧化硫,为干燥充分,导气管长进短出,则a连接g连接h,二氧化硫的密度比空气大,故导气管深入集气瓶底部,再连接e连接f,二氧化硫不能排放至空气中,用碱性试剂吸收;
(2)①装置中有氧气会干扰后面的实验;
②通过观察三颈烧瓶(或装置G)中通入二氧化硫导管中的气泡数控制硫酸的滴入速度,调节止水夹K1来控制SO2的流速;
③合成保险粉的反应物为ZnS2O4和NaOH,结合质量守恒书写方程式;
(3)根据5S2O42-~6MnO4-,计算样品中Na2S2O4的质量,据此计算样品中Na2S2O4的质量分数.
解答 解:(1)①实验室用亚硫酸钠与浓硫酸反应制备二氧化硫,选择A装置,化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
故答案为:A;Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②A装置制备二氧化硫,用浓硫酸干燥二氧化硫,为干燥充分,导气管长进短出,则a连接g连接h,二氧化硫的密度比空气大,故导气管深入集气瓶底部,再连接e连接f,二氧化硫不能排放至空气中,用碱性试剂吸收;
故答案为:g,h,e,f,i(e);
(2)①装置中有氧气会氧化锌,所以原因为:排除装置中的氧气;
故答案为:排除装置中的氧气;
②通过观察三颈烧瓶(或装置G)中通入二氧化硫导管中的气泡数控制硫酸的滴入速度,调节止水夹K1来控制SO2的流速;
故答案为:三颈烧瓶(或装置G)中通入二氧化硫导管中的气泡数;
③合成保险粉的反应物为ZnS2O4和NaOH,生成Na2S2O4和Zn(OH)2,反应的方程式为ZnS2O4+2NaOH=Na2S2O4+Zn(OH)2↓;
故答案为:ZnS2O4+2NaOH=Na2S2O4+Zn(OH)2↓;
(3)Na2S2O4与KMnO4反应产物为Na2SO4和MnSO4,则硫元素共升高6价,锰元素共降低5价,化合价升降应相同,故关系为5S2O42-~6MnO4-,
5 6
n 12×10-3L×0.1mol/L
则2 g样品中Na2S2O4的质量分数为=$\frac{5×12×1{0}^{-3}×0.1÷6×174×10}{2}×100%$=87%;
故答案为:87%.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺序、实验基本操作能力及计算,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.

| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 标准状况下,4.48LCH3C1中所含原子数为NA | |
| C. | 1LpH=1的H2SO4溶液中含有的H+数为0.2NA | |
| D. | 常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2 NA | |
| B. | 0.1 mol/L (NH4)2SO4溶液与0.2 mol/L NH4Cl溶液中的NH4+数目相同 | |
| C. | 标准状况下,H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
 电解尿素的碱性溶掖可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列有关说法中不正确的是( )
电解尿素的碱性溶掖可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列有关说法中不正确的是( )| A. | 电解过穆中b极附近溶液碱性明显增强 | |
| B. | 溶液中的OH-逐渐向a极区附近移动 | |
| C. | 若在b极产生标准状况下224mL氢气,则消耗尿素2g | |
| D. | a极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O |
| A. | 简单氢化物的沸点:X<W | B. | 元素的非金属性:W<X | ||
| C. | Y、Z的氧化物均含有离子键 | D. | Y、W形成的化合物的水溶液显碱性 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向某食盐溶液中滴加淀粉溶液,溶液颜色没有变为蓝色 | 不是加碘食盐 |
| B | 某溶液中加入硝酸酸化的Ba(NO3)2溶液,无现象,再滴加AgNO3溶液,有白色沉淀生成 | 溶液中一定含有Cl- |
| C | 室温下,用pH试纸分别测0.100mol•L-1 CH3COONa溶液和0.100mol•L-1 Na2S溶液的pH,后者pH大 | 酸性:H2S<CH3COOH |
| D | 将气体X分别通入溴水和酸性高锰酸钾溶液,两溶液均褪色 | 气体X一定是C2H4 |
| A. | A | B. | B | C. | C | D. | D |
 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH•H2O)]=l.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH•H2O)]=l.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液中:c[(CH3)2NH2+]>c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
| A. | 20℃时,饱和NaCl溶液的溶解度:S=$\frac{5850c}{ρ-58.5}$g | |
| B. | 此溶液中NaCl的质量分数为:$\frac{58.5×c}{ρ×1000}$×100% | |
| C. | 20℃时,密度小于ρ g•cm-3的NaCl溶液是不饱和溶液 | |
| D. | 温度低于20℃时,饱和NaCl溶液的浓度小于cmol•L-1 |
| A. | pH=1的溶液:HCO3-、Na+、ClO-、NO3- | |
| B. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| C. | 水电离出的c(H+)=10-4 mol/L的溶液:Na+、K+、SO42-、CO32- | |
| D. | 使石蕊呈红色的溶液:NH4+、NO3-、AlO2-、I- |