题目内容
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 标准状况下,4.48LCH3C1中所含原子数为NA | |
| C. | 1LpH=1的H2SO4溶液中含有的H+数为0.2NA | |
| D. | 常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
分析 A.铁在氧气中燃烧生成四氧化三铁,铁化合价为+$\frac{8}{3}$价;
B.依据n=$\frac{V}{Vm}$计算4.48LCH3C1物质的量,结合1个CH3C1含有5个原子解答;
C.pH=1的H2SO4溶液,C(H+)=0.1mol/L;
D.氨气与氯化氢反应生成氯化铵固体.
解答 解:A..6gFe物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,在氧气中燃烧,完全反应时转移电子数为$\frac{0.8}{3}$NA,故A错误;
B.标准状况下,4.48LCH3C1中所含原子数为$\frac{4.48L}{22.4L/mol}$×5×NA=NA,故B正确;
C.1LpH=1的H2SO4溶液中含有的H+数为0.1mol/L×1L×NA=0.1NA,故C错误;
D.常温下,1.7gNH3和3.65gHCl混合后反应生成0.1mol氯化铵,氯化铵为固体,不含气体分子,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,注意氯化铵常温下状态,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
9.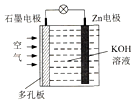 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )| A. | Zn电极是该电池的正极 | |
| B. | Zn电极的电极反应:Zn+H2O-2e-═ZnO+2H+ | |
| C. | OH-向石墨电极移动 | |
| D. | 氧气在石墨电极上发生还原反应 |
17.下列离子组不能在溶液中大量共存并会同时产生沉淀和气体的是( )
| A. | Fe2+、NO3-、K+、Cl- | B. | K+、Al3+、HCO3-、Cl- | ||
| C. | H+、Ca2+、HCO3-、Cl- | D. | Ca2+、HCO3-、OH-、NO3- |
14.请选择适当的试剂,用以除去括号内的杂质,并写出相关的化学方程式
A 氯水 B、Fe C、CO2 D、稀盐酸 E、NaOH溶液 F、氨水
A 氯水 B、Fe C、CO2 D、稀盐酸 E、NaOH溶液 F、氨水
| 物 质 | 加入试剂 | 有关化学方程式 |
| NaHCO3 (Na2CO3)(溶液) | ||
| MgO(Al2O3) |
11.利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应可表示为: ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | NBD和Q二者互为同分异构体 | |
| B. | 物质NBD的分子式为C7H7 | |
| C. | 物质Q的一氯取代物有2种 | |
| D. | 一定条件下,1molNBD最多可与2molBr2发生加成反应 |
18.下列叙述正确的是( )
| A. | 通常,同周期元素的第一电离能ⅦA族的元素最大 | |
| B. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| C. | 第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大 | |
| D. | 主族元素的原子形成单原子离子时的化合价数都和它的族序数相等 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.