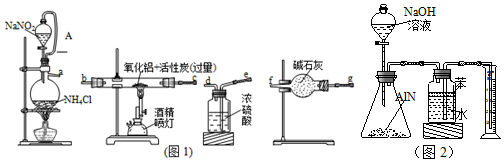
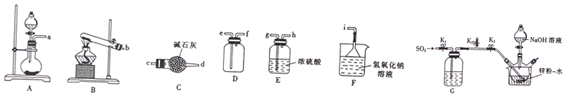
题目内容
8. 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH•H2O)]=l.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH•H2O)]=l.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液中:c[(CH3)2NH2+]>c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
分析 (CH3)2NH•H2O)为弱电解质,在溶液中部分电离,等浓度时离子浓度比NaOH小,则导电性较弱,由此可知②为(CH3)2NH•H2O的变化曲线,①为NaOH的变化曲线,加入HCl,(CH3)2NH•H2O溶液中离子浓度逐渐增大,导电性逐渐增强,NaOH与盐酸发生中和反应,离子浓度减小,由图象可知加入HCl10mL时完全反应,以此解答该题.
解答 解:A.由分析可知,曲线②为(CH3)2NH•H2O的变化曲线,故A错误;
B.①为NaOH的变化曲线,a点溶液中,溶质为NaCl和HCl,故B错误;
C.d点溶液中,存在质子守恒,即:c(H+)=c(OH-)+c[(CH3)2NH•H2O],故C正确;
D.b点溶液中溶质为(CH3)2NH2Cl和(CH3)2NH•H2O,(CH3)2NH•H2O电离出氢氧根离子抑制水的电离,c点溶质为NaCl对水的电离无影响,e点的溶液中溶质为(CH3)2NH2Cl和HCl,HCl抑制水的电离,所以c点水的电离程度最大,故D错误.
故选C.
点评 本题以电导率为载体考查离子浓度大小比较、盐类水解等知识点,题目难度中等,明确混合溶液中溶质及其性质、溶液导电性强弱影响因素是解本题关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
18.下列叙述正确的是( )
| A. | 通常,同周期元素的第一电离能ⅦA族的元素最大 | |
| B. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| C. | 第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大 | |
| D. | 主族元素的原子形成单原子离子时的化合价数都和它的族序数相等 |
3. 常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )
常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )
 常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )
常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )| A. | X、Y、Z三种元素可能组成是离子化合物 | |
| B. | 反应②为化合反应,反应③为置换反应 | |
| C. | 常温常压下,Z的氢化物熔点为同族最高 | |
| D. | 原子半径:Y>Z>X |
20.能正确表示下列反应的离子方程式是( )
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 向碳酸钠溶液中逐滴加入等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
8.10毫升0.1mol/L的XO4-离子恰好将15毫升0.1mol/L的亚硫酸钠氧化,则元素X在还原产物中的化合价为多少( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |