题目内容
3.乙二酸(HOOC-COOH)与乙醇(C4H10O)在一定条件下反应,生成的二酯有( )| A. | 12种 | B. | 10种 | C. | 8种 | D. | 6种 |
分析 分子式为C4H10O的醇可以看作丁烷被-OH取代,CH3CH2CH2CH3被取代时有2种醇,CH2CH(CH3)CH3被取代时有2种醇,故醇共有4种,可以是一种醇与乙二酸形成二酯,也可以是不同的2种醇与乙二酸形成二酯,据此进行解答.
解答 解:分子式为C4H10O的醇可以看作丁烷被-OH取代,CH3CH2CH2CH3被取代时有2种醇,CH2CH(CH3)CH3被取代时有2种醇,故醇共有4种,当一种醇与乙二酸形成二酯,有4种;
不同的2种醇与乙二酸形成二酯,有C42种组合,则形成的酯的种类为:$\frac{4×3}{2}$=6种,
所以总共形成的二酯共有:4+6=10种,
故选B.
点评 本题考查了同分异构体书写,题目难度不大,明确酯化反应原理为解答关键,注意掌握同分异构体的概念及书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.已知A、B、C、D、E是短周期中原子序数一次增大5种主族元素,其中元素A、E的单 质常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是( )
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | D单质能够溶解于C的最高价氧化物对应的水化物 |
11.已知 X、Y、Z、M、R五种元素中,原子序数X<Y<Z<M<R,其结构或性质信息如下表.请根据信息回答有关问题:
(1)元素M的原子核外共有17种不同运动状态的电子,有5种不同能级的电子.
(2)X、Y、Z三种元素的第一电离能较高的是N(写元素符号),原因是N原子的2p能级电子为半充满,为较稳定的结构.
(3)R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
(2)X、Y、Z三种元素的第一电离能较高的是N(写元素符号),原因是N原子的2p能级电子为半充满,为较稳定的结构.
(3)R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O.
15.X、Y、Z、W是原子序数依次增大的短周期元素,X最高正价与最低负价的代数和为零,Y、Z易形成质量比为3:4和3:8的两种常见化合物,含W元素的物质其焰色反应为黄色.下列说法正确的是( )
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
12. 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
17.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | 熔点:Na>MgO>SiO2 | B. | 水溶性:SO2>H2S>HCl | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 沸点:HF>HCl>HBr |

 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷.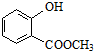 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.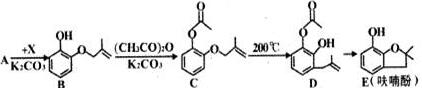
 .
.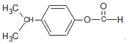 .
.