题目内容
17.在通常条件下,下列各组物质的性质排列正确的是( )| A. | 熔点:Na>MgO>SiO2 | B. | 水溶性:SO2>H2S>HCl | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 沸点:HF>HCl>HBr |
分析 A.晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体;
B.依据二氧化硫、硫化氢、氯化氢溶解性解答;
C.元素的非金属性越强,对应的氢化物越稳定;
D.分子晶体中,气态氢化物的熔沸点与其相对分子质量成正比,但氢键影响氢化物的熔沸点.
解答 解:A.晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,则熔点为SiO2>MgO>Na,故A错误;
B.二氧化硫、硫化氢、氯化氢溶解性顺序为:HCl>SO2>H2S,故B错误;
C.非金属性:F>O>N,则氢化物稳定性:HF>H2O>NH3,故C正确;
D.分子晶体中,气态氢化物的熔沸点与其相对分子质量成正比,但氢键影响氢化物的熔沸点,所以沸点:HF>HBr>HCl,故D错误;
故选:C.
点评 本题考查较综合,考查了不同晶体类型熔点规律、元素的非金属性判断依据、分子晶体熔沸点高低的判断等,解题时注意氢键对物质熔沸点的影响,题目难度中等.

练习册系列答案
相关题目
3.乙二酸(HOOC-COOH)与乙醇(C4H10O)在一定条件下反应,生成的二酯有( )
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 6种 |
5.下列说法不正确的是( )
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |
9.下列反应能用离子方程式CO32-+Ba2+═BaCO3↓表示的有( )
| A. | BaCl2与K2CO3溶液反应 | B. | CO2与Ba(OH)2溶液反应 | ||
| C. | Ba(NO3)2与Na2CO3溶液反应 | D. | Ba(OH)2与少量NaHCO3溶液反应 |
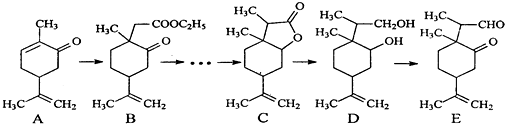
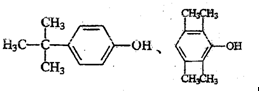 .
.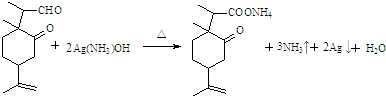 .
.
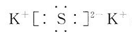 ,A属于离子化合物.
,A属于离子化合物.