题目内容
12. 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
分析 A.根据草酸氢钠溶液中的电荷守恒、物料守恒判断;
B.根据图象可知,c(HC2O4ˉ)>amol•L-1时,c(C2O42-)>c(H2C2O4),说明草酸氢根离子的电离程度大于其水解程度;
C.根据图象可知Ka(HC2O4ˉ)=a时,氢离子与醋酸的浓度相等,然后结合草酸氢根离子的电离平衡常数的表达式计算;
D.反应后溶质为0.04mol/L的NaHC2O4溶液,根据图象可知c(C2O42-)>c(H+)>c(H2C2O4).
解答 解:A.根据NaHC2O4溶液中的物料守恒得c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42- ),根据电荷守恒可得:c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42- )+c(OH-),二者结合可得:c(H2C2O4)+c(H+)=c(C2O42- )+c(OH-),则c(H+)=c(C2O42-)+c(OH-)-c(H2C2O4),所以c(H+)>c(C2O42-)-c(H2C2O4),故A正确;
B.当c(HC2O4ˉ)>amol•L-1时,c(H+)<c(H2C2O4),根据图象可知,c(HC2O4ˉ)>amol•L-1时,c(C2O42-)>c(H2C2O4),则HC2O4ˉ的水解程度小于电离程度,故B错误;
C.Ka(HC2O4ˉ)=a时c(H+)=c(H2C2O4),由于草酸氢根的电离程度较小,则c(HC2O4ˉ)≈amol•L-1,Ka(HC2O4ˉ)=$\frac{c({C}_{2}{{O}_{4}}^{2-})•c({H}^{+})}{c(H{C}_{2}{{O}_{4}}^{-})}$=$\frac{1.2×1{0}^{-3}×2.4×1{0}^{-3}}{a}$,草酸的电离平衡常数为:$\frac{c(H{C}_{2}{{O}_{4}}^{-})•c({H}^{+})}{c({H}_{2}{C}_{2}C{O}_{4})}$=c(HC2O4ˉ)≈a,草酸的第二步电离小于第一步电离,则Ka(HC2O4ˉ)<a,故C错误;
D.将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),反应后溶质为0.04mol/L的NaHC2O4溶液,根据图象可知c(C2O42-)>c(H+)>c(H2C2O4),正确的离子浓度大小为:c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H+)>c(H2C2O4)>c(OH-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义,试题培养了学生的分析能力及灵活应用能力.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案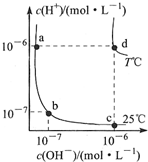
| A. | d点对应的食盐水pH=6,呈中性 | |
| B. | 向a点对应的醋酸溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-) | |
| C. | T℃时,0.05mol/LBa(OH)2溶液的pH=11 | |
| D. | a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同 |
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 6种 |
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:C02(g)+3H2(g)?CH3OH(g)+H20(g)△H几种化学键的键能如表所示
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
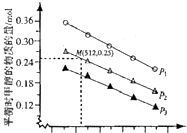
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该由池由储500mLImol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
已知Ksp[Mg(OH)2]=1.2xl0-11 Ksp[Ca(OH)2]=5.5X10-6
(2)处理过的废气中S02的含量可以通过碘暈法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中S02的含量$\frac{0.224}{at}$(用含a,t的式子表示)
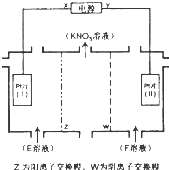
| A. | X为负极,F溶液NaNO3溶液 | |
| B. | 电解一段时间,往Pt片(I)附近滴入酚酞,溶液变红 | |
| C. | 电解总反应方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| D. | 理论上,当得到0.1molKNO3时,Pt片(Ⅱ)上生成标准状况下为1.12L的气体 |
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |


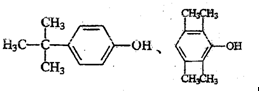 .
.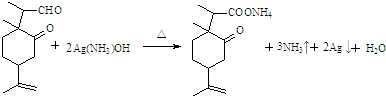 .
.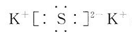 ,A属于离子化合物.
,A属于离子化合物.