题目内容
8.呋喃酚是生产农药克百威的重要中间体,其合成路线如下: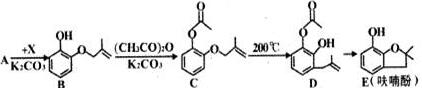
已知有机物A的分子式为C6H6O2,与FeCl3溶液反应显紫色
(1)B→C的反应类型是取代反应,E的分子式是C10H12O2,1molD最多可以消耗3molNaOH.
(2)已知X的分子式为C4H2Cl,写出A→B的化学方程式
 .
.(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名法)是4-氯-1-丁烯.
(4)下列有关化合物C、D的说法不正确的是①③(填序号).
①C和D含有的官能团完全相同
②C和D互为同分异构体
③等物质的量的C和D分别于足量溴水反应消耗Br2的物质的量相同
(5)B的同分异构体很多,符合下列条件的有15种(不考虑立体异构),写出其中核磁共振氢谱峰面积比为1:1:2:2:6的结构简式
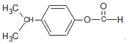 .
.①苯环上有两个取代基 ②能发生银镜反应 ③能发生水解反应
(6)已知CH2=CH2+HClO→HOCH2CH2Cl,表示出由(CH3)3CH合成X的路线图.
(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
分析 (1)对比B、C的结构可知,B中酚-OH上的H被取代;由E的结构可知书写其分子式;D中酚羟基与氢氧化钠反应,且酯基水解得到羧基、酚羟基与氢氧化钠反应;
(2)对比A、B的结构,可知A→B属于取代反应,则X为CH2=CH(CH3)CH2Cl,反应还有HCl生成;
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y为CH2=CHCH2CH2Cl;
(4)C、D分子式相同,结构不同,互为同分异构体,C、D均含有碳碳双键,能与溴发生加成反应,而C含有醚键、D含有酚羟基,二者含有官能团不同,酚羟基邻位、对位能与溴发生取代反应;
(5)B的芳香族同分异构体满足:①苯环上有两个取代基,②能发生银镜反应,说明含有醛基,③能发生水解反应,含有甲酸形成的酯基,2个取代基为-CH3、-CH2CH2OOCH,或者为-CH3、-CH(CH3)OOCH,
或者为-CH2CH3、-CH2OOCH,或者为-CH2CH2CH3、-OOCH,或者为-CH(CH3)2、-OOCH,各有邻、间、对3种;
(6)(CH3)3CH光照生成(CH3)2CHCH2Cl,在氢氧化钠醇溶液、加热条件下发生消去反应生成(CH3)2C=CH2,与HClO发生加成反应生成 ,最后在浓硫酸、加热条件下发生消去反应生成CH2=CH(CH3)CH2Cl.
,最后在浓硫酸、加热条件下发生消去反应生成CH2=CH(CH3)CH2Cl.
解答 解:(1)对比B、C的结构可知,B中酚-OH上的H被取代,B→C的反应属于取代反应;由E的结构可知,其分子式为C10H12O2;D中酚羟基与氢氧化钠反应,且酯基水解得到羧基、酚羟基与氢氧化钠反应,1molD最多可以消耗3molNaOH,
故答案为:取代反应;C10H12O2;3;
(2)对比A、B的结构,可知A→B属于取代反应,则X为CH2=CH(CH3)CH2Cl,反应还有HCl生成,反应方程式为: ,
,
故答案为: ;
;
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y为CH2=CHCH2CH2Cl,系统命名为:4-氯-1-丁烯,故答案为:4-氯-1-丁烯;
(4)①C含有醚键、D含有酚羟基,二者含有官能团不完全同,故①错误;
②C、D分子式相同,结构不同,互为同分异构体,故②正确;
③碳碳双键均与溴发生加成反应,C含有醚键、D含有酚羟基,D中酚羟基对位可以与溴发生取代反应,消耗Br2的物质的量不相同,故③错误;
故答案为:①③;
(5)B的芳香族同分异构体满足:①苯环上有两个取代基,②能发生银镜反应,说明含有醛基,③能发生水解反应,含有甲酸形成的酯基,2个取代基为-CH3、-CH2CH2OOCH,或者为-CH3、-CH(CH3)OOCH,
或者为-CH2CH3、-CH2OOCH,或者为-CH2CH2CH3、-OOCH,或者为-CH(CH3)2、-OOCH,各有邻、间、对3种,共有15种,其中核磁共振氢谱峰面积比为1:1:2:2:6的结构简式为: ,
,
故答案为:15; ;
;
(6)(CH3)3CH光照生成(CH3)2CHCH2Cl,在氢氧化钠醇溶液、加热条件下发生消去反应生成(CH3)2C=CH2,与HClO发生加成反应生成 ,最后在浓硫酸、加热条件下发生消去反应生成CH2=CH(CH3)CH2Cl,合成路线流程图为:
,最后在浓硫酸、加热条件下发生消去反应生成CH2=CH(CH3)CH2Cl,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的合成、有机物结构与性质、同分异构体书写等,注意根据合成流程中的反应、官能团变化等分析解答,侧重分析与应用能力的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 可以选用方案Ⅰ分离NaCl中的I2 | |
| B. | 方案Ⅰ中X物质不可能是受热易分解的物质 | |
| C. | 方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3 | |
| D. | 方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂 |
| A. | ①③④⑤⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ①④⑤⑦ |
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 6种 |
| A. | 1mol ${\;}_{92}^{235}$U核素含有中子数为235NA | |
| B. | 1 L 0.l mol•L-1的醋酸溶液中含有H+数目为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 常温常压下,l.6gCH4中含有共价键总数为0.4 NA |
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:C02(g)+3H2(g)?CH3OH(g)+H20(g)△H几种化学键的键能如表所示
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
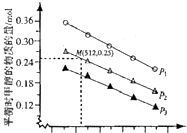
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该由池由储500mLImol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
已知Ksp[Mg(OH)2]=1.2xl0-11 Ksp[Ca(OH)2]=5.5X10-6
(2)处理过的废气中S02的含量可以通过碘暈法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中S02的含量$\frac{0.224}{at}$(用含a,t的式子表示)
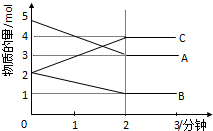 某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:
某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则: