��Ŀ����
13����ͭ����Ҫ�ɷ�Cu2S�������������SiO2��Fe2O3�����ʣ����̿���Ҫ����MnO2���Լ�����SiO2��Fe2O3�����ʣ��о���Ա�����ۺ�������������Դ����ͬ�����ʪ��ұ�����գ��Ʊ������̾���ͼ�ʽ̼��ͭ����Ҫ�����������£�
��֪��
��MnO2�н�ǿ�������ԣ��ܽ����������е�������Ϊ������
��[Cu��NH3��4]SO4�����ȶ�������ˮ��Һ�л�ֽ�����NH3��
�۲��ֽ��������������������������pH��Χ����ʼ��������ȫ������pH����
Fe3+��1.5��3.2 Mn2+��8.3��9.8 Cu2+��4.4��6.4
��MnSO4•H2O����1����ˮ��0.6�ݷ�ˮ���������Ҵ���
��1��ʵ��������250mL 4.8mol•L-1��ϡ���ᣬ����IJ�������������������Ͳ���ձ������Ҫ250mL����ƿ����ͷ�ιܣ�
��2�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ�з����ʯ���ʵ������¶Ȼ��߽��裨��дһ�㣩��
��3�����ʱ���õ�����Һ����Ҫ����CuSO4��MnSO4�ȣ�д���÷�Ӧ�Ļ�ѧ����ʽ��Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+S��+4H2O��
��4�����ڽ���ҺpH=4��������ʹFe3+��ȫˮ��������������������
��5���������п�ѭ��ʹ�õ�������NH3��д��ѧʽ����
��6����õ�MnSO4•H2O������Ҫ��һ��ϴ�ӡ����ϴ��ʱӦ�þƾ�ϴ�ӣ�
��7���ⶨMnSO4•H2O��Ʒ�Ĵ��ȣ�ȷ��ȡ��Ʒ14.00g��������ˮ���100mL��Һ��ȡ��25.00mL�ñ���BaCl2��Һ�ⶨ����ȫ��Ӧ��õ���4.66g�����������Ʒ�Ĵ���Ϊ96.57%��
���� ��1������250mL��Һ����Ҫ250mL����ƿ������Ҫ��ͷ�ιܶ��ݣ�
��2����ʯ�Ŀ�����С���¶ȼ��Ƿ����Ȼ�Ӱ���ȡ�ʣ�
��3��MnO2�н�ǿ�������ԣ��ܽ����������е�������Ϊ��������������CuSO4��MnSO4��S����Ӧ�������ᡢ�������̺�����ͭ�����ݻ��ϼ���������ƽ��
��4������������ʼ����PH=1.5����ȫ����PH=3.2��Cu2+����ʼ������4.4��ʹFe3+��ȫ������Cu2+��������PH��Χ�ǣ�3.2��4.4��
��5�����ݹ������̿��Կ�������ѭ��ʹ�õ������ǰ�����
��6��MnSO4•H2O�����ھƾ����ܽ��С��
��7�����ݵζ���Ӧ���ɵij���Ϊ���ᱵ�����Ԫ���غ����õ���Ʒ���ȣ�
��� �⣺��1������һ�����ʵ���Ũ�ȵ���Һ���ز����ٵ�������ƿ�ͽ�ͷ�ιܣ�����ƿҪ������������ʹ��250mL����ƿ��
�ʴ�Ϊ��250mL����ƿ����ͷ�ιܣ�
��2���������ʱ��ʯ������СӰ���ȡ�ʣ�����ͨ�������ʯ��߽�ȡ�ʣ��������ʵ������¶Ȼ��߽�����߽�ȡ�ʣ�
�ʴ�Ϊ�������ʯ���ʵ������¶Ȼ��߽��裻
��3��������Ϣ��MnO2�ܽ����������е�������Ϊ������Ӧ����Cu2S��MnO2��H2SO4 ����������CuSO4��MnSO4��S��
������ͭ�������壬���ϼ۱仯�ǣ���1��2+2��1��=4��MnԪ�ػ��ϼ۱仯�ǣ�4-2=2�����Զ������̻�ѧ��������2������ͭ����1���ٸ��ݹ۲취��ƽ�������ʣ���Ӧ�Ļ�ѧ����ʽ�ǣ�Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S��+4H2O��
�ʴ�Ϊ��Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S��+4H2O��
��4�����ݽ��������������������������pH��Χ��ʹFe3+��ȫ������Cu2+��������PH��Χ�ǣ�3.2��4.4����ѡ��PH=4Ŀ����ʹFe3+��ȫˮ��������������������
�ʴ�Ϊ��ʹFe3+��ȫˮ��������������������
��5�����������У������˰�ˮ������ֵõ��˰�����NH3 ��ѭ��ʹ�ã��ʴ�Ϊ��NH3 ��
��6���ھƾ��У������̾����ܽ��С���ʻ�õ�MnSO4•H2O������þƾ�ϴ�ӣ�
�ʴ�Ϊ���ƾ���
��7���ⶨMnSO4•H2O��Ʒ�Ĵ��ȣ�ȷ��ȡ��Ʒ14.00g��������ˮ���100mL��Һ��ȡ��25.00mL�ñ���BaCl2��Һ�ⶨ����ȫ��Ӧ��õ���4.66g������Ϊ���ᱵ���ʵ���=$\frac{4.66g}{233g/mol}$=0.02mol��n��MnSO4•H2O��=n��BaSO4��=0.02mol�������Ʒ��MnSO4•H2O���ʵ���Ϊ��0.02mol��$\frac{100}{25}$=0.08mol������Ʒ��MnSO4•H2O�Ĵ���=$\frac{0.08mol��169g/mol}{14.00g}$��100%=96.57%��
�ʴ�Ϊ��96.57%��
���� ���⿼���������̾������ȡ�����ʷ����ᴿ����Һ�����ơ��к͵ζ�ԭ����Ӧ�õȣ��漰��֪ʶ��Ƚ϶࣬�����ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ�������ͼ�����������Ŀ�Ѷ��еȣ�

| ������ | Fe��OH��2 | Fe��OH��3 | FePO4 | Fe3��PO4��2 |
| Ksp����ֵ | 10-17 | 10-38 | 10-22 | 10-36 |
��2��Ϊ���FePO4�IJ��ʣ����������Ʊ������ͱ������ݣ�Ӧ��ȡ����ȷ��ʩ��d������ȷ�𰸵ı�ţ���
a������H2O2 b��������ҺpH��5
c�����ͷ�Ӧ�¶� d������NH4H2PO4������
��3���ĺ�����H3PO2��������NaOH��Һ��Ӧ������NaH2PO2����H3PO2ΪһԪ���LiFePO4�еĻ�ѧ�������Ӽ������ۼ������Ʊ�LiFePO4�Ĺ����м���H2C2O4�������ǻ�ԭFePO4��
��4��LiFePO4����﮵�صĵ缫���ϣ����ʱ��Li+��LiFePO4������Ǩ�Ƴ���������LiFePO4ת��ΪLi1-xFePO4���������ĵ缫��ӦʽΪLiFePO4-xe-�TLi1-xFePO4+xLi+��
��5���绯ѧ��ԭTiO2�ǻ�ȡ�����ѵij��÷���������������������ʣ���ʯī���������ܷ�ӦΪTiO2$\frac{\underline{\;���\;}}{\;}$Ti+O2����
�ٵ������У��������ϱ����Ķ���Ҫ���ڸ�������ԭ����2O2--4e-�TO2����C+O2=CO2���÷�Ӧʽ��ʾ����
�ڵ���ɺ�80%FeTiO3����������ȡ��TiO2�õ�12Kg�����ѣ���֪����Ч��Ϊ76%����������Ҫ����������62.5kg��������Ч��=$\frac{ʵ�ʲ���}{���۲���}$��100%��
| A�� | ˮ�����c�� H+��=1xl0-13 mol/L����Һ�У�K+��Na+��SiO32-��SO42- | |
| B�� | 1.0 mol/L��CH3COOH��Һ��K+��Fe3+��NO3-��Cl- | |
| C�� | ��c��OH-����c��H+��=1��1012����Һ��NH4+��Ca2+��C1-��K+ | |
| D�� | �����Ի�ɫ����Һ��Na+��CO32-��NO3-��SO32- |
| A�� | ��ѧҩƷ�Ż𣬶�Ҫ������ˮ����ĭ�������� | |
| B�� | ������Ư�۳���������ˮ�ľ����������ߵ�����ԭ������ͬ | |
| C�� | ʳƷ��װ���г�����С������ʯ�ң�Ŀ���Ƿ�ֹʳƷ�������� | |
| D�� | ��ά���������ڿ�ˮ��Ϊ�����ǣ��ʿ��������Ӫ������ |

| A�� | ����ѡ�÷��������NaCl�е�I2 | |
| B�� | ��������X���ʲ������������ֽ������ | |
| C�� | �������м���NaOH��Һ���Է������SiO2��Fe2O3 | |
| D�� | �������м����Ҳ�������ܹ��ܽ��X����������ʵ��Լ� |
| A�� | ̼�����ƿ������Ʊ��������θ������ҩ�� | |
| B�� | θ�������˲��˳Ժ��������⡢ƻ��������ʳ�� | |
| C�� | ������ά���ϳ���ά���ά�����л��߷��ӻ����� | |
| D�� | 1mol��������ˮ���2mol�Ҵ���2mol������̼ |
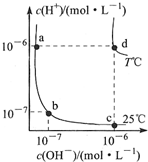
| A�� | d���Ӧ��ʳ��ˮpH=6�������� | |
| B�� | ��a���Ӧ�Ĵ�����Һ�еμ�NaOH��Һ��b�㣬��ʱc��Na+��=c��CH3COO-�� | |
| C�� | T��ʱ��0.05mol/LBa��OH��2��Һ��pH=11 | |
| D�� | a���Ӧ��ϡ������c���Ӧ��CH3COONa��Һ��ˮ�ĵ���̶���ͬ |
| A�� | 12�� | B�� | 10�� | C�� | 8�� | D�� | 6�� |
 ��
��