题目内容
15.X、Y、Z、W是原子序数依次增大的短周期元素,X最高正价与最低负价的代数和为零,Y、Z易形成质量比为3:4和3:8的两种常见化合物,含W元素的物质其焰色反应为黄色.下列说法正确的是( )| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
分析 X、Y、Z、W是原子序数依次增大的短周期元素,含W元素的物质其焰色反应为黄色,则W为Na元素;Y、Z原子序数小于Na,Y、Z易形成质量比为3:4和3:8的两种常见化合物,即CO、CO2,所以Y为C元素、Z为O元素,X的原子序数小于C,而且X最高正价与最低负价的代数和为零,则X为H元素;结合元素周期率知识解答该题.
解答 解:A.Y为碳元素,C元素的单质金刚石为原子晶体,熔点最高,故A错误;
B.W为Na元素,NaH为离子化合物,故B错误;
C.电子层数越多,原子半径越大,电子层数相同时,原子序数越大,原子半径越小,所以原子半径:Z<Y<W,故C错误;
D.C、H可以形成既有极性键也有非极性键的化合物,如C2H4,故D正确.
故选D.
点评 本题考查结构性质位置关系应用,题目难度中等,侧重于学生的分析能力的考查,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
5.生活中碰到的某些问题常常涉及到化学知识,下列分析正确的是( )
| A. | 碳酸氢钠可用于制备纯碱、治疗胃酸过多的药剂 | |
| B. | 胃酸过多的人不宜吃海带、鸡肉、苹果等酸性食物 | |
| C. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 1mol葡萄糖能水解成2mol乙醇和2mol二氧化碳 |
6.向盛有硫酸锌水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到透明溶液.下列对此现象说法不正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
3.乙二酸(HOOC-COOH)与乙醇(C4H10O)在一定条件下反应,生成的二酯有( )
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 6种 |
10.化学与生活紧密联系,下列说法不正确的是( )
| A. | Na2SiO3水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | Fe3O4俗称铁红,可用作红色涂料 | |
| C. | Na2CO3俗称纯碱,可作为制造玻璃的原料 | |
| D. | KAl(SO4)2•12H2O俗称明矾,可作为净水剂 |
20. 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.
Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:C02(g)+3H2(g)?CH3OH(g)+H20(g)△H几种化学键的键能如表所示
通过计算得出△H=-2208kJ/mol.
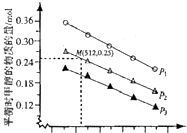
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该由池由储500mLImol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
(1)海水经初步处理后,还含有Ca2+、Mg2+,Na+、CL-,向其中加入石灰浆使海水中的Mg2+转换 为Mg(OH)2,当Mg2+刚好沉淀完全时,c( Ca2+)为4.58mol/L
已知Ksp[Mg(OH)2]=1.2xl0-11 Ksp[Ca(OH)2]=5.5X10-6
(2)处理过的废气中S02的含量可以通过碘暈法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中S02的含量$\frac{0.224}{at}$(用含a,t的式子表示)
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:C02(g)+3H2(g)?CH3OH(g)+H20(g)△H几种化学键的键能如表所示
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该由池由储500mLImol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
已知Ksp[Mg(OH)2]=1.2xl0-11 Ksp[Ca(OH)2]=5.5X10-6
(2)处理过的废气中S02的含量可以通过碘暈法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中S02的含量$\frac{0.224}{at}$(用含a,t的式子表示)
7.电解KCL和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,以下说法正确的是( )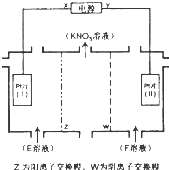

| A. | X为负极,F溶液NaNO3溶液 | |
| B. | 电解一段时间,往Pt片(I)附近滴入酚酞,溶液变红 | |
| C. | 电解总反应方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| D. | 理论上,当得到0.1molKNO3时,Pt片(Ⅱ)上生成标准状况下为1.12L的气体 |
9.下列反应能用离子方程式CO32-+Ba2+═BaCO3↓表示的有( )
| A. | BaCl2与K2CO3溶液反应 | B. | CO2与Ba(OH)2溶液反应 | ||
| C. | Ba(NO3)2与Na2CO3溶液反应 | D. | Ba(OH)2与少量NaHCO3溶液反应 |
 .
.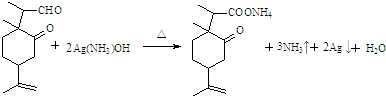 .
.