题目内容
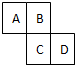 如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.
如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.(1)写出A、B、C、D的元素符号:A
(2)A、B、C、D的气态氢化物最不稳定的是(写化学式)
(3)A、D两元素的气态氢化物相互反应的化学方程式为
(4)写出下列电子式:D的气态氢化物
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D均为短周期元素,由元素在周期表中位置可知,A、B处于第二周期,C、D处于第三周期,令C的原子序数为x,则A的原子序数为x-9,D的原子序数为x+1,A与D原子序数之和是C的原子序数的1.5倍,则x-9+x+1=1.5x,解得x=16,则C为S元素,B为O元素,A为N元素,D为Cl元素,据此解答.
解答:
解:A、B、C、D均为短周期元素,由元素在周期表中位置可知,A、B处于第二周期,C、D处于第三周期,令C的原子序数为x,则A的原子序数为x-9,D的原子序数为x+1,A与D原子序数之和是C的原子序数的1.5倍,则x-9+x+1=1.5x,解得x=16,则C为S元素,B为O元素,A为N元素,D为Cl元素,
(1)由上述分析可知,A为N元素,B为O元素,C为S元素,D为Cl元素,故答案为:N;O;S;Cl;
(2)上述元素中S元素非金属性最弱,故H2S最不稳定,故答案为:H2S;
(3)A、D两元素的气态氢化物分别为氨气、HCl,二者反应生成氯化铵,反应方程式为:NH3+HCl=NH4Cl,现象是:有白烟生成,氯化铵属于离子化合物,含有离子键、共价键,
故答案为:NH3+HCl=NH4Cl;有白烟生成;离子;离子键、共价键;
(4)D的气态氢化物为HCl,H原子与Cl原子之间形成1对共用电子对,电子式为: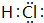 ,A单质为N2,分子中N原子之间形成3对共用电子对,电子式为
,A单质为N2,分子中N原子之间形成3对共用电子对,电子式为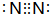 ,
,
故答案为: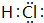 ;
;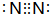 .
.
(1)由上述分析可知,A为N元素,B为O元素,C为S元素,D为Cl元素,故答案为:N;O;S;Cl;
(2)上述元素中S元素非金属性最弱,故H2S最不稳定,故答案为:H2S;
(3)A、D两元素的气态氢化物分别为氨气、HCl,二者反应生成氯化铵,反应方程式为:NH3+HCl=NH4Cl,现象是:有白烟生成,氯化铵属于离子化合物,含有离子键、共价键,
故答案为:NH3+HCl=NH4Cl;有白烟生成;离子;离子键、共价键;
(4)D的气态氢化物为HCl,H原子与Cl原子之间形成1对共用电子对,电子式为:
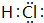 ,A单质为N2,分子中N原子之间形成3对共用电子对,电子式为
,A单质为N2,分子中N原子之间形成3对共用电子对,电子式为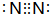 ,
,故答案为:
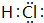 ;
;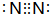 .
.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握同主族元素原子序数关系,难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
106g Na2CO3和84g NaHCO3分别与足量的盐酸溶液反应,其中( )
| A、Na2CO3消耗的盐酸多 |
| B、NaHCO3放出的CO2多 |
| C、Na2CO3放出的CO2多 |
| D、NaHCO3消耗的盐酸多 |
能在水溶液中大量共存的一组离子是( )
| A、H+、I-、NO3-、SiO32- |
| B、K+、Na+、NO3-、MnO4- |
| C、Ag+、Fe3+、Cl-、SO42- |
| D、NH4+、OH-、Cl-、HCO3- |
 某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得: