题目内容
(1)已知标准状况下11.2L X气体的质量为16g,则该X气体的物质的量为 ,其摩尔质量为 ;
(2)12.4g Na2X中含0.4molNa+,则Na2X的摩尔质量是 ,X的相对原子质量是 .
(3)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0L该矿泉水中含有72mg Mg2+,则Mg2+的物质的量浓度为 .
(2)12.4g Na2X中含0.4molNa+,则Na2X的摩尔质量是
(3)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0L该矿泉水中含有72mg Mg2+,则Mg2+的物质的量浓度为
考点:物质的量的相关计算
专题:计算题
分析:(1)根据n=
计算气体物质的量,根据M=
计算其摩尔质量;
(2)Na+为0.4mol,则Na2X为0.2mol,根据M=
计算Na2X摩尔质量,进而计算X的相对原子质量;
(3)根据n=
计算 Mg2+的物质的量,再根据c=
计算 Mg2+物质的量浓度.
| V |
| Vm |
| m |
| n |
(2)Na+为0.4mol,则Na2X为0.2mol,根据M=
| m |
| n |
(3)根据n=
| m |
| M |
| n |
| V |
解答:
解:(1)气体物质的量=
=0.5mol,其摩尔质量=
=32g/mol,
故答案为:0.5mol;32g/mol;
(2)Na+为0.4mol,则Na2X为0.2mol,Na2X摩尔质量=
=62g/mol,故X的相对原子质量=62-23×2=16,
故答案为:62g/mol;16;
(3)72mg Mg2+的物质的量=
=0.003mol,Mg2+物质的量浓度=
=0.003mol/L,
故答案为:0.003mol/L.
| 11.2L |
| 22.4L/mol |
| 16g |
| 0.5mol |
故答案为:0.5mol;32g/mol;
(2)Na+为0.4mol,则Na2X为0.2mol,Na2X摩尔质量=
| 12.4g |
| 0.2mol |
故答案为:62g/mol;16;
(3)72mg Mg2+的物质的量=
| 0.072g |
| 24g/mol |
| 0.003mol |
| 1L |
故答案为:0.003mol/L.
点评:本题考查物质的量有关计算,比较基础,侧重对基础知识的巩固,注意对公式的理解与灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体、容量瓶自己配制480mL含NaClO 25%密度为1.19g?cm-3的消毒液.下列说法正确的是( )
| A、配制过程只需要三种仪器即可完成 |
| B、容量瓶用蒸馏水洗净后可以不烘干立即用于溶液的配制 |
| C、所配得的NaClO消毒液在空气中光照久置后溶液中NaClO物质的量浓度增大 |
| D、需要称量NaClO固体的质量为140g |
设NA表示阿伏伽德罗常数的数值,下列说法中正确的是( )
| A、0.5mol?L-1 Fe2(SO4)3溶液中含有SO42-数为1.5NA |
| B、7.8g Na2O2溶于水后,所得溶液中含有O22-数为NA |
| C、标准状况下,22.4L Cl2与足量的铁粉反应,转移的电子数为3NA |
| D、常温常压下,7.0g乙烯和丙烯的混合物中含有氢原子的数目为NA |
 目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应.应用如图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应.应用如图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. W、X、Y、Z为原子序数依次增大的前四周期元素,其中W、X、Y为主族元素.用X的氧化物漂白的草帽日久又变成黄色;基态W原子有两个单电子,且与X不同周期不同族,X、Y同周期,基态Z原子电子分属7个能级,且各能级均为全充满.
W、X、Y、Z为原子序数依次增大的前四周期元素,其中W、X、Y为主族元素.用X的氧化物漂白的草帽日久又变成黄色;基态W原子有两个单电子,且与X不同周期不同族,X、Y同周期,基态Z原子电子分属7个能级,且各能级均为全充满.

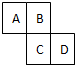 如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.
如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.