题目内容
I、在反应3BrF3+5H2O=HBrO3+Br2+O2↑+9HF中:
(1)氧化剂(BrF3 )-获得电子-化合价降低-发生还原反应(被还原)-生成还原产物;
同理得出:还原剂 - 电子-化合价 -发生 -生成 .
(2)若有90g水参加反应,则被还原的BrF3为 g.(Br:80;F:19)
(3)若有54g水被氧化,则被还原的BrF3为 g.
II、某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O.
(1)该反应的氧化剂为 .
(2)如果该反应方程式中I2和KIO3的系数都为5.配平化学方程式并用单线桥标出电子转移的方向和数目 .
(1)氧化剂(BrF3 )-获得电子-化合价降低-发生还原反应(被还原)-生成还原产物;
同理得出:还原剂
(2)若有90g水参加反应,则被还原的BrF3为
(3)若有54g水被氧化,则被还原的BrF3为
II、某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O.
(1)该反应的氧化剂为
(2)如果该反应方程式中I2和KIO3的系数都为5.配平化学方程式并用单线桥标出电子转移的方向和数目
考点:氧化还原反应
专题:氧化还原反应专题
分析:I、在反应3BrF3+5H2O=HBrO3+Br2+O2↑+9HF中,Br元素的化合价由+3价升高为+5价,O元素的化合价由-2价升高为0,Br元素的化合价由+3价降低为0,以此分析;
II、KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O中,Mn元素的化合价由+7价降低为+2价,I元素的化合价由-1价分别升高为0、+5价,以此解答.
II、KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O中,Mn元素的化合价由+7价降低为+2价,I元素的化合价由-1价分别升高为0、+5价,以此解答.
解答:
解:I、(1)Br、O元素的化合价升高,则BrF3和H2O-失去电子-化合价升高-发生氧化反应(被氧化),生成氧化产物,
故答案为:BrF3和H2O;失去;升高;氧化反应(被氧化);氧化产物;
(2)有90g水参加反应,其物质的量为
=5mol,由反应及Br原子守恒可知,2molBrF3被还原,其质量为2mol×137g/mol=274g,故答案为:274;
(3)有54g水被氧化,其物质的量为
=3mol,由电子守恒可知,还原的BrF3为
=2mol,其质量为2mol×137g/mol=274g,故答案为:274;
II(1)Mn元素的化合价降低,则KMnO4为氧化剂,故答案为:KMnO4;
(2)该反应方程式中I2和KIO3的系数都为5,失去电子为5×2×(1-0)+5×[5-(-1)]=40,由电子守恒可知,KMnO4的系数为
=8,该反应为8KMnO4+15KI+17H2SO48=MnSO4+5I2+5KIO3+9K2SO4+17H2O,用单线桥标出电子转移的方向和数目为 ,
,
故答案为: .
.
故答案为:BrF3和H2O;失去;升高;氧化反应(被氧化);氧化产物;
(2)有90g水参加反应,其物质的量为
| 90g |
| 18g/mol |
(3)有54g水被氧化,其物质的量为
| 54g |
| 18g/mol |
| 3mol×(2-0) |
| (5-3) |
II(1)Mn元素的化合价降低,则KMnO4为氧化剂,故答案为:KMnO4;
(2)该反应方程式中I2和KIO3的系数都为5,失去电子为5×2×(1-0)+5×[5-(-1)]=40,由电子守恒可知,KMnO4的系数为
| 40 |
| (7-2) |
 ,
,故答案为:
 .
.
点评:本题考查氧化还原反应,为高频考点,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重氧化还原反应配平、转移电子及基本概念的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
下列平衡常数中,表示的正反应程度最大的是( )
| A、K=10-1 |
| B、K=10-7 |
| C、K=1 |
| D、K=1010 |
若用NA表示阿伏伽德罗常数,则相对分子质量为M的物质的一个分子的质量(以克为单位)是( )
| A、MNA | ||
B、
| ||
C、
| ||
D、
|

 W、X、Y、Z为原子序数依次增大的前四周期元素,其中W、X、Y为主族元素.用X的氧化物漂白的草帽日久又变成黄色;基态W原子有两个单电子,且与X不同周期不同族,X、Y同周期,基态Z原子电子分属7个能级,且各能级均为全充满.
W、X、Y、Z为原子序数依次增大的前四周期元素,其中W、X、Y为主族元素.用X的氧化物漂白的草帽日久又变成黄色;基态W原子有两个单电子,且与X不同周期不同族,X、Y同周期,基态Z原子电子分属7个能级,且各能级均为全充满.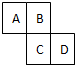 如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.
如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.