题目内容
能在水溶液中大量共存的一组离子是( )
| A、H+、I-、NO3-、SiO32- |
| B、K+、Na+、NO3-、MnO4- |
| C、Ag+、Fe3+、Cl-、SO42- |
| D、NH4+、OH-、Cl-、HCO3- |
考点:离子共存问题
专题:离子反应专题
分析:根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答:
解:A.H+、I-、NO3-发生氧化还原反应,H+、SiO32-结合生成沉淀,不能共存,故A错误;
B.该组离子之间不反应,可共存,故B正确;
C.Ag+、Cl-结合生成沉淀,不能共存,故C错误;
D.NH4+、OH-结合生成弱电解质,OH-、HCO3-结合生成水和碳酸根离子,不能共存,故D错误;
故选B.
B.该组离子之间不反应,可共存,故B正确;
C.Ag+、Cl-结合生成沉淀,不能共存,故C错误;
D.NH4+、OH-结合生成弱电解质,OH-、HCO3-结合生成水和碳酸根离子,不能共存,故D错误;
故选B.
点评:本题考查离子的共存,为高频考点,把握常见离子的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
若用NA表示阿伏伽德罗常数,则相对分子质量为M的物质的一个分子的质量(以克为单位)是( )
| A、MNA | ||
B、
| ||
C、
| ||
D、
|
一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g)?2CO2(g)+S(l)△H<0
一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2.下列说法正确的是( )
一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2.下列说法正确的是( )
| A、反应前2min的平均速率v(SO2)=0.1amol/(L.min) |
| B、当混合气体的物质的量不再改变时,反应达到平衡状态 |
| C、平衡后保持其它条件不变,从容器中分离出部分硫,平衡向正反应方向移动 |
| D、平衡后保持其他条件不变,升高温度和加入催化剂,SO2的转化率均增大 |
反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少了0.6mol/L.此反应速率的表示正确的是( )
| A、用A表示的反应速率是0.4mol/(L?min) |
| B、用C表示的速率是0.2mol/(L?min) |
| C、在2min末的反应速率,用B表示是0.3mol/(L?min) |
| D、用D表示的反应速率是0.2mol/(L?min) |
设NA表示阿伏伽德罗常数的数值,下列说法中正确的是( )
| A、0.5mol?L-1 Fe2(SO4)3溶液中含有SO42-数为1.5NA |
| B、7.8g Na2O2溶于水后,所得溶液中含有O22-数为NA |
| C、标准状况下,22.4L Cl2与足量的铁粉反应,转移的电子数为3NA |
| D、常温常压下,7.0g乙烯和丙烯的混合物中含有氢原子的数目为NA |
在5L Na2SO4溶液中含有Na+4.6g,则溶液中SO42-的物质的量浓度为( )
| A、0.2mol?L-1 |
| B、0.04mol?L-1 |
| C、0.08mol?L-1 |
| D、0.02mol?L-1 |
铜锌原电池产生电流时,电解质溶液中离子移动方向为( )
| A、阳离子移向Cu极,阴离子移向Zn极 |
| B、阳离子移向Zn极,阴离子移向Cu极 |
| C、阳离子和阴离子都移向Cu极 |
| D、阳离子和阴离子都移向Zn极 |
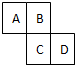 如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.
如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.


