题目内容
 某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:(1)在4min末时,A、B的物质的量浓度c(A)
(2)从反应开始至4min时,A的平均反应速率为
(3)该反应的化学方程式为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据图象可知,在4min末时,A、B的物质的量浓度均为0.2mol/L,从0~4min内A、B的物质的量浓度变化量△c(A)=0.4mol/L-0.2mol/L=0.2mol/L,△c(B)=0.2mol/L-0.1mol/L=0.2mol/L,故△c(A)>△c(B),据此判断;
(2)根据v=
计算反应速率;
(3)根据参加反应的物质的物质的量浓度变化之比等于化学计量数之比书写化学方程式.
(2)根据v=
| △c |
| △t |
(3)根据参加反应的物质的物质的量浓度变化之比等于化学计量数之比书写化学方程式.
解答:
解:(1)根据图象可知,在4min末时,A、B的物质的量浓度均为0.2mol/L,从0~4min内A、B的物质的量浓度变化量△c(A)=0.4mol/L-0.2mol/L=0.2mol/L,△c(B)=0.2mol/L-0.1mol/L=0.2mol/L,故△c(A)>△c(B),故答案为:=;>;
(2)反应开始至4min时,A的平均反应速率为:v=
=
═0.05mol/(L?min),
故答案为:0.05mol/(L?min);
(3)由图象可知,A的物质的量逐渐减小,应为反应物,B的物质的量逐渐增加,应为生成物,参加反应的物质的物质的量之比等于化学计量数之比,
则n(A):n(B)=(0.8mol-0.4mol):(0.4mol-0.2mol)=2:1,所以反应的化学方程式为:2A B,故答案为:2A
B,故答案为:2A B.
B.
(2)反应开始至4min时,A的平均反应速率为:v=
| △c |
| △t |
| 0.4mol/L-0.2mol/L |
| 4min |
故答案为:0.05mol/(L?min);
(3)由图象可知,A的物质的量逐渐减小,应为反应物,B的物质的量逐渐增加,应为生成物,参加反应的物质的物质的量之比等于化学计量数之比,
则n(A):n(B)=(0.8mol-0.4mol):(0.4mol-0.2mol)=2:1,所以反应的化学方程式为:2A
 B,故答案为:2A
B,故答案为:2A B.
B.
点评:本题考查化学反应速率变化曲线及应用和转化率的计算,题目难度不大,注意分析图象曲线的变化趋势,把握化学平衡状态的特征.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
若用NA表示阿伏伽德罗常数,则相对分子质量为M的物质的一个分子的质量(以克为单位)是( )
| A、MNA | ||
B、
| ||
C、
| ||
D、
|
在5L Na2SO4溶液中含有Na+4.6g,则溶液中SO42-的物质的量浓度为( )
| A、0.2mol?L-1 |
| B、0.04mol?L-1 |
| C、0.08mol?L-1 |
| D、0.02mol?L-1 |
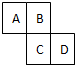 如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.
如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍.