题目内容
硫酸亚铁晶体(FeSO4?7H2O)在医药上作补血剂.为测定补血剂中铁元素含量,甲同学设计了如图方案:请回答下列问题:
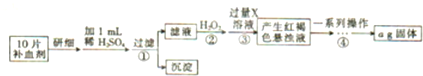
(1)写出步骤②反应的离子方程式: .
(2)步骤②中除了H2O2外还可以使用的物质是 (任写一种).
(3)步骤④中一系列操作中包括洗涤沉淀,其操作方法是 .
乙同学采用滴定法测定铁元素的含量,取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(共1.500g),研细后用蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,配成100mL溶液.取该溶液20.00mL与锥形瓶中,用1.200×10-2mol?L-1的KMnO4溶液滴定,消耗KMnO4溶液的体积为15.00mL.设计的离子方程式Fe2++MnO4-+H--Fe3++Mn2++H2O(未配平)、Fe3+(黄色)+2H3PO4=H3[Fe(PO4)2](无色)+3H+
(4)实验前,若要精确配制一定物质的量浓度的KMnO4溶液250mL,称量结束后配制时需要的仪器除玻璃棒、烧杯外,还需 (填仪器名称).
(5)滴定过程中KMnO4溶液盛放在 (填“酸”或“碱”)式滴定管中,H3PO4的作用是 .
(6)滴定过程中 (填“需要”或“不需要”)加入指示剂.
(7)根据实验数据,计算该补血剂中铁元素的含量是 .

(1)写出步骤②反应的离子方程式:
(2)步骤②中除了H2O2外还可以使用的物质是
(3)步骤④中一系列操作中包括洗涤沉淀,其操作方法是
乙同学采用滴定法测定铁元素的含量,取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(共1.500g),研细后用蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,配成100mL溶液.取该溶液20.00mL与锥形瓶中,用1.200×10-2mol?L-1的KMnO4溶液滴定,消耗KMnO4溶液的体积为15.00mL.设计的离子方程式Fe2++MnO4-+H--Fe3++Mn2++H2O(未配平)、Fe3+(黄色)+2H3PO4=H3[Fe(PO4)2](无色)+3H+
(4)实验前,若要精确配制一定物质的量浓度的KMnO4溶液250mL,称量结束后配制时需要的仪器除玻璃棒、烧杯外,还需
(5)滴定过程中KMnO4溶液盛放在
(6)滴定过程中
(7)根据实验数据,计算该补血剂中铁元素的含量是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水.
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,加入其他物质所起作用同样是把Fe2+全部氧化为Fe3+;
(3)洗涤沉淀在过滤器中进行,用水浸没沉淀,让水自然流下,重复操作2-3次;
(4)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、玻璃棒、烧杯、胶头滴管,250mL容量瓶;
(5)酸性高锰酸钾具有强氧化性,应放在酸式滴定管中;根据题给信息可知磷酸所起作用;
(6)高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色;
(7)配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,以此计算.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水.
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,加入其他物质所起作用同样是把Fe2+全部氧化为Fe3+;
(3)洗涤沉淀在过滤器中进行,用水浸没沉淀,让水自然流下,重复操作2-3次;
(4)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、玻璃棒、烧杯、胶头滴管,250mL容量瓶;
(5)酸性高锰酸钾具有强氧化性,应放在酸式滴定管中;根据题给信息可知磷酸所起作用;
(6)高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色;
(7)配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,以此计算.
解答:
解:(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,加入其他物质所起作用同样是把Fe2+全部氧化为Fe3+,考虑不能引入新的杂质,故可用氯水来氧化亚铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;故答案为:氯水;
(3)洗涤沉淀在过滤器中进行,用水浸没沉淀,让水自然流下,重复操作2-3次;故答案为:向漏斗中加入蒸馏水至浸没沉淀,待蒸馏水流完后,重复操作2~3次;
(5)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、玻璃棒、烧杯、胶头滴管,250mL容量瓶;
故答案为:250mL容量瓶、胶头滴管;
(5)酸性高锰酸钾具有强氧化性,应放在酸式滴定管中;根据题给信息可知Fe3+(黄色)+2H3PO4=H3[Fe(PO4)2](无色)+3H+,可消除铁离子的黄色对对滴定终点的干扰;故答案为:酸;消除Fe3+的颜色干扰;
(6)高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,故不需要加指示剂;故答案为:不需要;
(7)反应需要的高锰酸钾的物质的量为=1.200×10-2mol?L-1×0.015L=1.8×10-4mol
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n 1.8×10-4mol
n=
=9×10-4mol,
则1.500g硫酸亚铁补血剂药片含铁的质量为9×10-4mol×5×56g/mol=0.252g,所以该补血剂中铁元素的含量为
×100%=16.8%,
故答案为:16.8%.
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,加入其他物质所起作用同样是把Fe2+全部氧化为Fe3+,考虑不能引入新的杂质,故可用氯水来氧化亚铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;故答案为:氯水;
(3)洗涤沉淀在过滤器中进行,用水浸没沉淀,让水自然流下,重复操作2-3次;故答案为:向漏斗中加入蒸馏水至浸没沉淀,待蒸馏水流完后,重复操作2~3次;
(5)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、玻璃棒、烧杯、胶头滴管,250mL容量瓶;
故答案为:250mL容量瓶、胶头滴管;
(5)酸性高锰酸钾具有强氧化性,应放在酸式滴定管中;根据题给信息可知Fe3+(黄色)+2H3PO4=H3[Fe(PO4)2](无色)+3H+,可消除铁离子的黄色对对滴定终点的干扰;故答案为:酸;消除Fe3+的颜色干扰;
(6)高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,故不需要加指示剂;故答案为:不需要;
(7)反应需要的高锰酸钾的物质的量为=1.200×10-2mol?L-1×0.015L=1.8×10-4mol
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n 1.8×10-4mol
n=
| 5mol×1.8×10-4mol |
| 1mol |
则1.500g硫酸亚铁补血剂药片含铁的质量为9×10-4mol×5×56g/mol=0.252g,所以该补血剂中铁元素的含量为
| 0.252g |
| 1.5g |
故答案为:16.8%.
点评:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原滴定应用、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
能正确表示下列反应的离子方程式为( )
| A、向明矾溶液中加入足量的氢氧化钡溶液Ba2++4OH-+Al3++SO42-=BaSO4↓+AlO2-+2H2O |
| B、酸性高锰酸钾溶液与草酸溶液混合2MnO4-+5C2O42-+16H+=2Mn2++10 CO2↑+8H2O |
| C、将等物质的量浓度的氯水与FeI2溶液混合2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl- |
| D、向氢氧化钡溶液中通入足量的SO2气体OH-+SO2=HSO3- |
下列实验现象对应的反应方程式正确的是( )
| A、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| B、切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2=2Na2O |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
容积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下反应N2+3H2?2NH3,达平衡时容积为V L,混合气体中氨气占总体积的20%,若压强温度不变,下列推论不正确的是( )
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
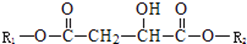 (其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化:
(其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化: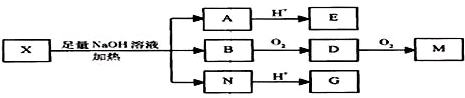
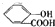 )中液加NaHCO3溶液
)中液加NaHCO3溶液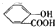 +2HCO3-═
+2HCO3-═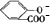 +2CO2↑+2H2O,
+2CO2↑+2H2O,