题目内容
容积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下反应N2+3H2?2NH3,达平衡时容积为V L,混合气体中氨气占总体积的20%,若压强温度不变,下列推论不正确的是( )
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
考点:化学平衡的计算
专题:
分析:根据体积之比等于物质的量之比,结合反应前后气体体积差来分析计算.
解答:
解:根据差量法:N2(g)+3H2(g)? 2NH3(g),△V(减小)
2NH3(g),△V(减小)
1 3 2 2
转化(L) 0.1V 0.3V 0.2V 0.2V
所以原N2、H2混合气体为V+0.2V=1.2V,A正确,B错误;
参与反应的N2为0.1V L,H2为0.3V L,还过剩1.2V-0.1V-0.3V=0.8V,所以氮气和氢气的量不确定,所以C正确,D错误,故选AD.
 2NH3(g),△V(减小)
2NH3(g),△V(减小)1 3 2 2
转化(L) 0.1V 0.3V 0.2V 0.2V
所以原N2、H2混合气体为V+0.2V=1.2V,A正确,B错误;
参与反应的N2为0.1V L,H2为0.3V L,还过剩1.2V-0.1V-0.3V=0.8V,所以氮气和氢气的量不确定,所以C正确,D错误,故选AD.
点评:本题主要考查了化学平衡的计算,利用体积之比等于物质的量之比,难度不大,解题时应注意运用好三段式进行计算.

练习册系列答案
相关题目
咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通的肥皂洗涤时,会发现黄色污渍变为红色,经水漂洗后红色又变黄色.据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用( )
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
用下列装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 |  | 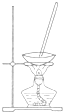 |  | 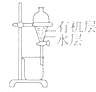 |
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
| A、A | B、B | C、C | D、D |
下列说法正确的是( )
| A、Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换 |
| B、Na2O2中阴阳离子数数目之比为1:1 |
| C、Cl2与SO2均能使品红褪色,说明二者均有氧化性 |
| D、NO能够与人体里的血红蛋白结合,造成人体缺氧中毒 |
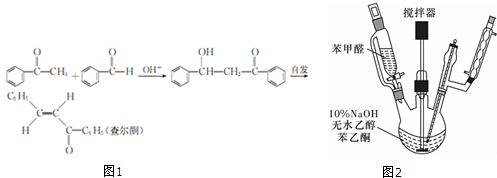
 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: