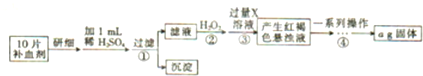
题目内容
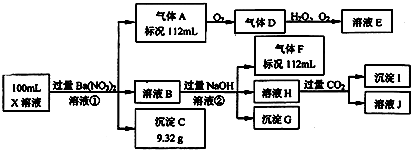
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是 .
(2)用离子方程表达下列反应:
①中生成气体A: .
②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl-)为 mol/L.(若有些离子不存在,请填0mol/L)

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是
(2)用离子方程表达下列反应:
①中生成气体A:
②中生成溶液H:
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为
考点:常见离子的检验方法
专题:
分析:在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,根据硫酸钡的质量可以计算硫酸根离子的物质的量,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子,根据NO的体积可以计算亚铁离子的量,溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答.
解答:
解:强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C9.32g为BaSO4,说明溶液中含有SO42-离子,根据硫酸钡的质量可以计算硫酸根离子的物质的量为
=0.04mol,浓度是
=0.4mol/L,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子,根据NO的体积可以计算亚铁离子的量,溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子物质的量是0.005mol,浓度是0.05mol/L,
;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)根据以上分析可知,溶液中不能确定的阳离子为Fe3+,溶液中不能确定的阴离子为Cl-,故答案为:Fe3+、Cl-;
(2)①中得到的气体A是NO,Fe2+离子被氧化为Fe3+离子,NO3-离子被还原为NO气体,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
②H是偏铝酸钠溶液,铝离子与过量氢氧化钠的反应,生成偏铝酸根离子和水,离子方程式是Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(3)根据反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,得到112mL0.005molNO,Fe2+的物质的量是0.015mol,所以原溶液中c(Fe2+)=
=0.15mol/L,加入氢氧化钠是60ml时,沉淀的量降为0.025mol,即氢氧化铁的物质的量是0.025mol,根据铁元素守恒,所以Fe3+的物质的量是0.01mol,所以原溶液中c(Fe3+)=
=0.1mol/L,硫酸根离子的物质的量为
=0.04mol,浓度是
=0.4mol/L,NH4+离子物质的量是0.005mol,浓度是0.05mol/L,Al3+的物质的量是0.005mol,浓度是0.05mol/L,
2c(Fe2+)+3c(Fe3+)+3c(Al3+)+c(NH4+)=(2×0.15+3×0.1+3×0.05+0.05)mol/L=0.8mol/L,2c(SO42-)=0.8mol/L,所以c(Cl-)为0,
故答案为:0.15; 0.1;0.
| 9.32g |
| 233g/mol |
| 0.04mol |
| 0.1L |
;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)根据以上分析可知,溶液中不能确定的阳离子为Fe3+,溶液中不能确定的阴离子为Cl-,故答案为:Fe3+、Cl-;
(2)①中得到的气体A是NO,Fe2+离子被氧化为Fe3+离子,NO3-离子被还原为NO气体,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
②H是偏铝酸钠溶液,铝离子与过量氢氧化钠的反应,生成偏铝酸根离子和水,离子方程式是Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(3)根据反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,得到112mL0.005molNO,Fe2+的物质的量是0.015mol,所以原溶液中c(Fe2+)=
| 0.015mol |
| 0.1L |
| 0.01mol |
| 0.1L |
| 9.32g |
| 233g/mol |
| 0.04mol |
| 0.1L |
2c(Fe2+)+3c(Fe3+)+3c(Al3+)+c(NH4+)=(2×0.15+3×0.1+3×0.05+0.05)mol/L=0.8mol/L,2c(SO42-)=0.8mol/L,所以c(Cl-)为0,
故答案为:0.15; 0.1;0.
点评:本题考查了常见阴阳离子的检验、无机推断,题目难度中等,注意掌握常见离子的性质及检验方法,(3)为难点、易错点,注意溶液电中性知识在化学计算中的应用方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )


| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
下列说法中不正确的是( )
| A、物质的量是可以把物质的质量与微观粒子数联系起来的一个基本物理量 |
| B、摩尔是国际单位制中七个基本物理量之一 |
| C、1mol任何微观粒子的质量以克为单位,数值上等于该粒子的相对原子(分子)质量 |
| D、含有6.02×1023个粒子的任何微观粒子集体计量为1摩尔 |
下列有关元素的性质及其递变规律正确的是( )
| A、同周期金属元素的最外层电子越多,其原子失电子能力越强 |
| B、对于HF、HCl、HBr其熔、沸点随其相对分子质量的增大而升高 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、同主族元素的简单阴离子还原性越强,其盐类的水解程度越大 |
标准状况下,两种气体的体积相等,则( )
| A、所含原子数一定相等 |
| B、物质的量一定相等 |
| C、质量一定相等 |
| D、密度一定相等 |