题目内容
下列操作,对应的现象及解释均正确的是( )
| 编号 | 操作 | 现象及解释 |
| A | 过量铁粉逐渐加入到一定量的浓硝酸中 | 溶液最终变为浅绿色是因为浓硝酸变稀后,稀硝酸只能把铁氧化成Fe2+:Fe+2H+═Fe2++H2↑ |
| B | 向水杨酸(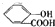 )中液加NaHCO3溶液 )中液加NaHCO3溶液 | 放出无色气体是因为水杨酸的酸性强于碳酸,反应生成CO2气体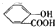 +2HCO3-═ +2HCO3-═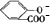 +2CO2↑+2H2O, +2CO2↑+2H2O, |
| C | 利用右边装置完成碳酸、醋酸和硅酸的酸性强弱比较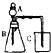 | B中固体溶解并产生气泡,C中出现白色沉淀是因为酸性:醋酸碳酸大于硅酸;B中离子方程式:CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 含有等浓度的SO42-和CO32-的溶液中滴加BaCl2溶液,将沉淀一分为二,一份经检验只含BaSO4,另一份放入饱和碳酸钠溶液一段时间,取出沉淀洗涤后放入盐酸中 | 放入盐酸中的沉淀溶解,且有气泡产生是因为Ksp[BaSO4]=1.1×10-30<Ksp[BaCO3]=5.1×10-9,因此SO42-先沉淀.但二者溶度积相差不大,BaSO4(s)+CO32-?BaCO3(s)+SO42- |
| A、A | B、B | C、C | D、D |
考点:铁的化学性质,难溶电解质的溶解平衡及沉淀转化的本质,有机物分子中的官能团及其结构
专题:
分析:A、过量铁粉和稀硝酸反应生成硝酸亚铁,稀硝酸可以将铁氧化为三家价离子;
B、酚羟基具有弱酸性,和碳酸氢钠之间不会发生反应,羧基能和碳酸氢钠之间反应;
C、可以根据元素的最高价含氧酸的酸性来判断非金属元素的氧化性强弱;
D、根据沉淀溶解平衡的移动结合沉淀的转化知识来回答.
B、酚羟基具有弱酸性,和碳酸氢钠之间不会发生反应,羧基能和碳酸氢钠之间反应;
C、可以根据元素的最高价含氧酸的酸性来判断非金属元素的氧化性强弱;
D、根据沉淀溶解平衡的移动结合沉淀的转化知识来回答.
解答:
解:A、过量铁粉逐渐加入到一定量的浓硝酸中,溶液最终变为浅绿色是因为金属铁和硝酸反应生成硝酸铁,过量的铁和硝酸铁之间反应生成硝酸亚铁的缘故,故A错误;
B、向水杨酸(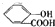 )中液加NaHCO3溶液放出无色气体是因为水杨酸中羧基的酸性强于碳酸,反应生成CO2气体的缘故,故B错误;
)中液加NaHCO3溶液放出无色气体是因为水杨酸中羧基的酸性强于碳酸,反应生成CO2气体的缘故,故B错误;
C、B中固体溶解并产生气泡,得到醋酸酸性强于碳酸,C中出现白色沉淀,是二氧化碳和硅酸钠溶液反应生成碳酸钠和硅酸的缘故,由此得到酸性:醋酸>碳酸>硅酸,B中离子方程式:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO-,故C错误;
D、硫酸根离子、碳酸根离子都可以和钡离子反应生成沉淀,硫酸钡沉淀中加入饱和的碳酸钠溶液,则会生成碳酸钡沉淀,碳酸钡溶于盐酸,得到氯化钡溶液、水以及二氧化碳,故D正确.
故选D.
B、向水杨酸(
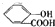 )中液加NaHCO3溶液放出无色气体是因为水杨酸中羧基的酸性强于碳酸,反应生成CO2气体的缘故,故B错误;
)中液加NaHCO3溶液放出无色气体是因为水杨酸中羧基的酸性强于碳酸,反应生成CO2气体的缘故,故B错误;C、B中固体溶解并产生气泡,得到醋酸酸性强于碳酸,C中出现白色沉淀,是二氧化碳和硅酸钠溶液反应生成碳酸钠和硅酸的缘故,由此得到酸性:醋酸>碳酸>硅酸,B中离子方程式:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO-,故C错误;
D、硫酸根离子、碳酸根离子都可以和钡离子反应生成沉淀,硫酸钡沉淀中加入饱和的碳酸钠溶液,则会生成碳酸钡沉淀,碳酸钡溶于盐酸,得到氯化钡溶液、水以及二氧化碳,故D正确.
故选D.
点评:本题是一道综合知识的考查题,考查学生对物质的性质的掌握,注意知识的归纳和梳理是解题的关键,难度较大.

练习册系列答案
相关题目
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢分子的质量之和 |
| B、常温常压下1mol NO2气体与水反应生成NA个NO3-离子 |
| C、121g CCl2F2所含的氯原子数为2NA |
| D、62g Na2O溶于水后所得溶液中含有O2-离子数为NA |
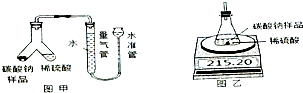 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验: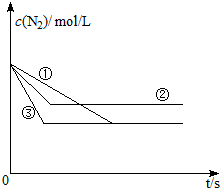 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: