题目内容
下列实验现象对应的反应方程式正确的是( )
| A、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| B、切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2=2Na2O |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
考点:离子方程式的书写
专题:
分析:A.硫化银的溶解度小于AgCl,所以AgCl能转化为Ag2S黑色沉淀;
B.钠和氧气反应生成白色固体氧化钠,在空气中燃烧生成过氧化钠;
C.过氧化钠和水反应生成氢氧化钠和氧气;
D.二者反应生成碳酸钙、NaOH和水.
B.钠和氧气反应生成白色固体氧化钠,在空气中燃烧生成过氧化钠;
C.过氧化钠和水反应生成氢氧化钠和氧气;
D.二者反应生成碳酸钙、NaOH和水.
解答:
解:A.硫化银的溶解度小于AgCl,所以AgCl能转化为Ag2S黑色沉淀,硫化银不能写沉淀符号,离子方程式为2AgCl+S2-=Ag2S+2Cl-,故A错误;
B.钠和氧气反应生成白色固体氧化钠,在空气中燃烧生成过氧化钠,在空气中的反应方程式为4Na+O2=2Na2O,故B正确;
C.过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,故C错误;
D.二者反应生成碳酸钙、NaOH和水,反应方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O,故D错误;
故选B.
B.钠和氧气反应生成白色固体氧化钠,在空气中燃烧生成过氧化钠,在空气中的反应方程式为4Na+O2=2Na2O,故B正确;
C.过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,故C错误;
D.二者反应生成碳酸钙、NaOH和水,反应方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O,故D错误;
故选B.
点评:本题考查离子方程式正误判断,明确离子性质及离子反应条件是解本题关键,要遵循客观事实、原子守恒、电荷守恒及转移电子守恒,注意有些反应与反应物的量及浓度有关,B中生成物与反应条件有关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,关于下列各溶液的叙述正确的是( )
| A、pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B、0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D、已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
下列各组中的两种物质作用时,反应条件或反应物用量改变时,对生成物没有影响的是( )
| A、Na2O2与CO2 |
| B、Na与O2 |
| C、NaOH与CO2 |
| D、Fe与HNO3 |
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢分子的质量之和 |
| B、常温常压下1mol NO2气体与水反应生成NA个NO3-离子 |
| C、121g CCl2F2所含的氯原子数为2NA |
| D、62g Na2O溶于水后所得溶液中含有O2-离子数为NA |
下列说法中不正确的是( )
| A、物质的量是可以把物质的质量与微观粒子数联系起来的一个基本物理量 |
| B、摩尔是国际单位制中七个基本物理量之一 |
| C、1mol任何微观粒子的质量以克为单位,数值上等于该粒子的相对原子(分子)质量 |
| D、含有6.02×1023个粒子的任何微观粒子集体计量为1摩尔 |
下列离子方程式的书写正确的是( )
| A、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| B、将少量SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO |
| C、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4+H2O |
| D、向Mg(OH)2浊液中滴入FeCl3溶液:3 Mg(OH)2(s)+2 Fe3+?2 Fe(OH)3(s)+3Mg2+ |
下列有关元素的性质及其递变规律正确的是( )
| A、同周期金属元素的最外层电子越多,其原子失电子能力越强 |
| B、对于HF、HCl、HBr其熔、沸点随其相对分子质量的增大而升高 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、同主族元素的简单阴离子还原性越强,其盐类的水解程度越大 |
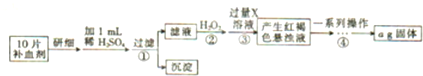
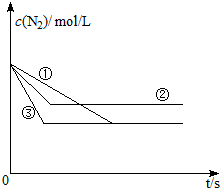 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: