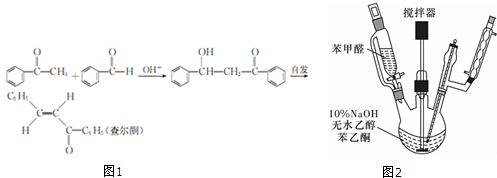
题目内容
今有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol?L-1,SO42-的浓度是0.7mol?L-1.
(1)写出Al2(SO4)3电离的电离方程式:
(2)Al3+浓度应等于 mol/L.
(1)写出Al2(SO4)3电离的电离方程式:
(2)Al3+浓度应等于
考点:物质的量浓度的相关计算,电离方程式的书写
专题:
分析:(1)硫酸铝是强电解质完全电离生成硫酸根离子和铝离子;
(2)溶液呈中性,根据电荷守恒求解;
(2)溶液呈中性,根据电荷守恒求解;
解答:
解:(1)硫酸铝是强电解质完全电离,电离方程式:Al2(SO4)3=2Al3++3SO42-;
故答案为:Al2(SO4)3=2Al3++3SO42-;
(2)溶液呈中性,根据电荷守恒列关系式:C(Al3+)×3+C(K+)=2×C(SO42-),将各种离子浓度带入得:C(Al3+)×3+0.2mol?L-1=2×0.7mol?L-1.
C(Al3+)=0.4mol/L;
故答案为:0.4mol/L;
故答案为:Al2(SO4)3=2Al3++3SO42-;
(2)溶液呈中性,根据电荷守恒列关系式:C(Al3+)×3+C(K+)=2×C(SO42-),将各种离子浓度带入得:C(Al3+)×3+0.2mol?L-1=2×0.7mol?L-1.
C(Al3+)=0.4mol/L;
故答案为:0.4mol/L;
点评:本题考查了电解质的电离和物质的量浓度的相关计算,掌握公式的运用是解题关键,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢分子的质量之和 |
| B、常温常压下1mol NO2气体与水反应生成NA个NO3-离子 |
| C、121g CCl2F2所含的氯原子数为2NA |
| D、62g Na2O溶于水后所得溶液中含有O2-离子数为NA |
下列离子方程式的书写正确的是( )
| A、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| B、将少量SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO |
| C、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4+H2O |
| D、向Mg(OH)2浊液中滴入FeCl3溶液:3 Mg(OH)2(s)+2 Fe3+?2 Fe(OH)3(s)+3Mg2+ |
下列有关元素的性质及其递变规律正确的是( )
| A、同周期金属元素的最外层电子越多,其原子失电子能力越强 |
| B、对于HF、HCl、HBr其熔、沸点随其相对分子质量的增大而升高 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、同主族元素的简单阴离子还原性越强,其盐类的水解程度越大 |
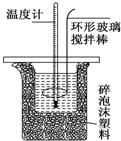 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
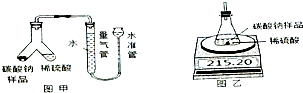 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验: