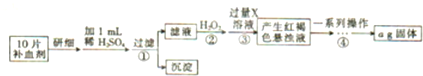
题目内容
能正确表示下列反应的离子方程式为( )
| A、向明矾溶液中加入足量的氢氧化钡溶液Ba2++4OH-+Al3++SO42-=BaSO4↓+AlO2-+2H2O |
| B、酸性高锰酸钾溶液与草酸溶液混合2MnO4-+5C2O42-+16H+=2Mn2++10 CO2↑+8H2O |
| C、将等物质的量浓度的氯水与FeI2溶液混合2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl- |
| D、向氢氧化钡溶液中通入足量的SO2气体OH-+SO2=HSO3- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.二者反应生成硫酸钡、偏铝酸钾和水,硫酸根离子、钡离子及硫酸钡的计量数都是2;
B.草酸是弱酸,应该写化学式;
C.还原性Fe2+<I-,所以氯气先氧化碘离子后氧化亚铁离子,等物质的量的氯水与FeI2溶液混合,假设二者都是1mol,则1mol氯气能氧化2mol碘离子;
D.二者反应生成亚硫酸氢钡.
B.草酸是弱酸,应该写化学式;
C.还原性Fe2+<I-,所以氯气先氧化碘离子后氧化亚铁离子,等物质的量的氯水与FeI2溶液混合,假设二者都是1mol,则1mol氯气能氧化2mol碘离子;
D.二者反应生成亚硫酸氢钡.
解答:
解:A.二者反应生成硫酸钡、偏铝酸钾和水,且离子方程式中硫酸根离子、钡离子和水的计量数都是2,所以离子方程式为Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,故A错误;
B.草酸是弱酸,应该写化学式,二者反应生成锰离子、二氧化碳和水,离子方程式为5H2C204+2MnO4-+6H+=10CO2↑+2Mn2++8H20,故B错误;
C.还原性Fe2+<I-,所以氯气先氧化碘离子后氧化亚铁离子,等物质的量的氯水与FeI2溶液混合,假设二者都是1mol,则1mol氯气能氧化2mol碘离子,离子方程式为2I-+Cl2=I2+2Cl-,故C错误;
D.二者反应生成亚硫酸氢钡,离子方程式为OH-+SO2=HSO3-,故D正确;
故选D.
B.草酸是弱酸,应该写化学式,二者反应生成锰离子、二氧化碳和水,离子方程式为5H2C204+2MnO4-+6H+=10CO2↑+2Mn2++8H20,故B错误;
C.还原性Fe2+<I-,所以氯气先氧化碘离子后氧化亚铁离子,等物质的量的氯水与FeI2溶液混合,假设二者都是1mol,则1mol氯气能氧化2mol碘离子,离子方程式为2I-+Cl2=I2+2Cl-,故C错误;
D.二者反应生成亚硫酸氢钡,离子方程式为OH-+SO2=HSO3-,故D正确;
故选D.
点评:本题考查离子方程式正误判断,明确离子性质及离子反应条件是解本题关键,注意A中反应物的量,反应物的量不同其产物不同,注意C中离子反应先后顺序,这些都是易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,关于下列各溶液的叙述正确的是( )
| A、pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B、0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D、已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
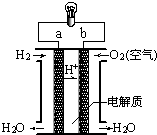

| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
下列各组中的两种物质作用时,反应条件或反应物用量改变时,对生成物没有影响的是( )
| A、Na2O2与CO2 |
| B、Na与O2 |
| C、NaOH与CO2 |
| D、Fe与HNO3 |
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢分子的质量之和 |
| B、常温常压下1mol NO2气体与水反应生成NA个NO3-离子 |
| C、121g CCl2F2所含的氯原子数为2NA |
| D、62g Na2O溶于水后所得溶液中含有O2-离子数为NA |