题目内容
13. 能源、环境与生产生活和社会发展密切相关.
能源、环境与生产生活和社会发展密切相关.(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如下:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO 2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②该温度下反应的平衡常数K=$\frac{25}{12}$L2•mol-2;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
③其他条件不变,达到平衡后,下列不能提高H2转化率的操作是a bd(填字母编号).
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图.据图可知,p1、p2、p3、p4由大到小的顺序P4>P3>P2>P1.
(3)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为1.60NA,阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.
分析 (1)①应用恒温恒容条件下的等效平衡知识来解决;甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ;
②平衡时能量变化放出29.4kJ,求平衡时各组分的浓度,然后求平均反应速率和平衡常数;
③根据外界条件对反应速率的影响分析判断;
(2)由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),据此结合方程式判断压强对平衡移动的影响进行解答;
(3)已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,利用盖斯定律将$\frac{①+②}{2}$可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-$\frac{574+1160}{2}$kJ•mol-1=867kJ•mol-1,以此解答该题.
解答 解:(1)①应用恒温恒容条件下的乙的投料量极端转化为甲相当于投1mol CO2(g)和3mol H2(g),所以两者是等效平衡,所以c1=c2,甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ,则a=49.0kJ-29.4kJ=19.6kJ,
故答案为:=;19.6;
②平衡时放出29.4kJ,则转化率为$\frac{29.4kJ}{49.0kJ}$×100%=60%
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始:1mol 3mol 0 0
转化:0.6mol 1.8mol 0.6mol 0.6mol
平衡:0.4mol 1.2mol 0.6mol 0.6mol
所以:达到平衡时,c(CO2)=0.2mol/L,c(H2)=0.6mol/L,c(CH3OH)=0.3mol/L,c(H2O)=0.3mol/L,
在该条件下,反应的平衡常数K的值=$\frac{0.3×0.3}{0.2×0.{6}^{3}}$=$\frac{25}{12}$;
平衡时能量变化放出29.4kJ,所以反应二氧化碳的物质的量为$\frac{29.4kJ}{49.0kJ}$=0.6mol,所以,然后求平均反应速率v=$\frac{\frac{0.6mol}{2L}}{10s}$=0.03mol/(L•min),v(H2)=3×0.03mol/(L•min)=0.09mol/(L•min),
故答案为:$\frac{25}{12}$;0.09;
③a.降低温度,二氧化碳反应速率减小,平衡逆向移动,氢气的转化率降低;
b.充入更多的H2,二氧化碳反应速率增大,平衡正向移动,氢气的转化率降低;
c.移去甲醇,二氧化碳反应速率减小,平衡正向移动,氢气的转化率增大;
d.增大容器体积,压强减小,二氧化碳反应速率减小,平衡逆向移动,氢气的转化率降低;
故提高CO2的反应速率,可以采取的反应条件是B;能提高H2转化率的操作是C;
故答案为:abd;
(2)由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1
故答案为:P4>P3>P2>P1;
(3)由(1)得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-$\frac{574+1160}{2}$kJ•mol-1=867kJ•mol-1,n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol×8NA=1.6NA=9.6×1023,放出的热量为0.2×867=173.4kJ,
故答案为:9.6×1023或1.60NA;173.4.
点评 本题考查化学平衡图象、影响化学平衡的因素、化学平衡常数等,注意利用“定一议二”原则分析解答.侧重于学生的计算能力和分析能力的考查,注意盖斯定律的应用,难度中等.

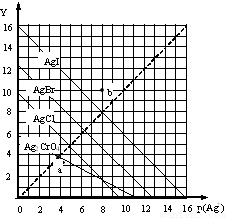 卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )
卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点时c(Ag+)=c(I-),AgI处于平衡状态 | |
| C. | b点可表示AgBr的不饱和溶液 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
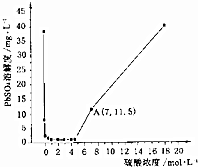 已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )
已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )| A. | 图中A点c(SO42-)=7mol•L-1 | |
| B. | 过滤的PbSO4沉淀,用稀硫酸洗涤,可以减少沉淀损耗 | |
| C. | 硫酸浓度大于5mol•L-1时,PbSO4溶解度增大的原因是转化成Pb(HSO4)2 | |
| D. | 将Pb(NO3)2、Ba(NO3)2混合溶液滴入稀硫酸中,能生成PbSO4和BaSO4两种沉淀 |
| A. | 有相同的中子数和质子数 | B. | 互为同位素 | ||
| C. | 物理性质相同 | D. | 核外电子数不同 |
 苯乙烯(
苯乙烯(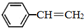 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△=-Q1kJ.mol-1
=CH2(g)+H2(g)△=-Q1kJ.mol-1 .
.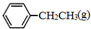 、
、 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.