题目内容
8.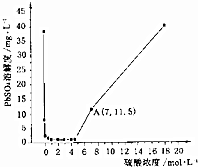 已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )
已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )| A. | 图中A点c(SO42-)=7mol•L-1 | |
| B. | 过滤的PbSO4沉淀,用稀硫酸洗涤,可以减少沉淀损耗 | |
| C. | 硫酸浓度大于5mol•L-1时,PbSO4溶解度增大的原因是转化成Pb(HSO4)2 | |
| D. | 将Pb(NO3)2、Ba(NO3)2混合溶液滴入稀硫酸中,能生成PbSO4和BaSO4两种沉淀 |
分析 A、根据PbSO4在A点中的溶解度计算铅离子浓度,再结合KSP(PbSO4)=1.6×10-8计算c(SO42-);
B、根据PbSO4沉淀溶解平衡PbSO4?Pb2++SO42-判断;
C、PbSO4沉淀溶解平衡PbSO4?Pb2++SO42-,硫酸浓度大于5mol•L-1时PbSO4溶解度增大,说明平衡正向移动,据此分析;
D、当离子积常数Qc大于其KSP,则生成PbSO4和BaSO4两种沉淀.
解答 解:A、因为A点硫酸浓度为7mol/L,此时PbSO4的溶解度为11.5mg/L,所以A点c(SO42-)=$\frac{K{\;}_{SP}(PbSO{\;}_{4})}{c(Pb{\;}^{2+})}$=$\frac{1.6×10{\;}^{-8}}{\frac{11.5×10{\;}^{-3}}{303}}$mol•L-1=3.2×10-4mol•L-1,故A错误;
B、因为PbSO4存在溶解平衡即PbSO4?Pb2++SO42-,所以用稀硫酸洗涤,增大硫酸根浓度,则平衡逆向移动,可以减少沉淀损耗,故B正确;
C、因为PbSO4存在溶解平衡即PbSO4?Pb2++SO42-,又硫酸浓度大于5mol•L-1时PbSO4溶解度增大,说明平衡正向移动,即硫酸根与氢离子和铅离子结合成Pb(HSO4)2,故C正确;
D、将Pb(NO3)2、Ba(NO3)2混合溶液滴入稀硫酸中,当离子积常数Qc大于其KSP,则生成PbSO4和BaSO4两种沉淀,故D正确;
故选:A.
点评 本题考查难熔电解质溶解平衡的移动及其有关溶度积的计算,难度不大,注意溶解平衡移动原理.

练习册系列答案
相关题目
5.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子 | |
| C. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
16.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-$→_{①转化}^{H+}$Cr2O72-$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)═Cr2O72-(aq)+H2O(l).转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
CrO42-$→_{①转化}^{H+}$Cr2O72-$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)═Cr2O72-(aq)+H2O(l).转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
3.烟气中含有SO2等大量有害物质,烟气除硫的方法有很多,其中石灰石法烟气除硫工艺的主要反应如下
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(s)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成的石灰膏的热化学反应方程式2CaCO3(s)+2SO2(g)+O2(g)+4H2O(l)=2[CaSO4•2H2O](s)+2CO2△H=-681.8kJ/mol
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3个不同的容器中进行反应
A.容器保持恒温恒压 B.容器保持恒温恒容 C.容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad
a.3个容器中SO2的平均转化率的大小顺序:aA>aB>aC
b.当A容器内气体的平均摩尔质量不变时说明该反应处于化学平衡状态
c.A,B两个容器达到平衡所用的时间tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下容器内SO2的质量如下表:
①在T1温度下,计算20-40min内SO2的反应速率2×10-5mol/(L.min)
②若其它条件都相同,则T1<T2(填“>”或“<”“=”下同):x>0.06
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度=原平衡时SO2的浓度(填“>”“<”或“=”),理由是该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等..
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(s)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成的石灰膏的热化学反应方程式2CaCO3(s)+2SO2(g)+O2(g)+4H2O(l)=2[CaSO4•2H2O](s)+2CO2△H=-681.8kJ/mol
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3个不同的容器中进行反应
A.容器保持恒温恒压 B.容器保持恒温恒容 C.容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad
a.3个容器中SO2的平均转化率的大小顺序:aA>aB>aC
b.当A容器内气体的平均摩尔质量不变时说明该反应处于化学平衡状态
c.A,B两个容器达到平衡所用的时间tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下容器内SO2的质量如下表:
| 时间/min SO2质量/10-3g 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
②若其它条件都相同,则T1<T2(填“>”或“<”“=”下同):x>0.06
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度=原平衡时SO2的浓度(填“>”“<”或“=”),理由是该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等..
13. 能源、环境与生产生活和社会发展密切相关.
能源、环境与生产生活和社会发展密切相关.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如下:
①cl= c2(填“>”、“<”或“=”),a=19.6;
②该温度下反应的平衡常数K=$\frac{25}{12}$L2•mol-2;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
③其他条件不变,达到平衡后,下列不能提高H2转化率的操作是a bd(填字母编号).
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
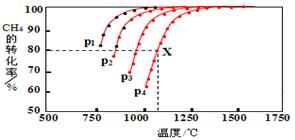
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图.据图可知,p1、p2、p3、p4由大到小的顺序P4>P3>P2>P1.
(3)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为1.60NA,阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.
 能源、环境与生产生活和社会发展密切相关.
能源、环境与生产生活和社会发展密切相关.(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如下:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO 2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②该温度下反应的平衡常数K=$\frac{25}{12}$L2•mol-2;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
③其他条件不变,达到平衡后,下列不能提高H2转化率的操作是a bd(填字母编号).
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图.据图可知,p1、p2、p3、p4由大到小的顺序P4>P3>P2>P1.
(3)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为1.60NA,阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.
20. 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
下列说法正确的是( )
 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
| 容器 | 温度/℃ | 起始物质的量/mol | |
| NO(g) | CO(g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 该反应的正反应为吸热反应 | |
| B. | 达到平衡时,乙中CO2的体积分数比甲中的小 | |
| C. | T1℃时,若起始时向甲中充入0.40molNO、0.40molCO、0.40molN2和0.40molCO2,则反应达到新平衡前v(正)<v(逆) | |
| D. | T2℃时,若起始时向丙中充入0.06molN2和0.12molCO2,则达平衡时N2的转化率大于40% |
18.下列各组溶液不用任何试剂,只用试管与胶头滴管就能鉴别的是( )
| A. | AlCl3与NH3•H2O | B. | NaOH、MgSO4 | C. | Al2(SO4)3、NaOH | D. | BaCl2、H2SO4 |