题目内容
2.下面有关12C、13C的叙述正确的是( )| A. | 有相同的中子数和质子数 | B. | 互为同位素 | ||
| C. | 物理性质相同 | D. | 核外电子数不同 |
分析 A.原子结构中质子数为6,质量数不同,质量数=质子数+中子数;
B.质子数相同中子数不同的同种元素的不同原子互为同位素;
C.原子结构中质量数不同,物理性质不同;
D.原子质子数相同,核外电子数相同.
解答 解:A.原子结构中质子数为6,质量数不同,质量数=质子数+中子数,12C中中子数=12-6=6、13C中子数=13-6=7,质子数相同,中子数不同,故A错误;
B.质子数相同中子数不同的同种元素的不同原子互为同位素,12C、13C的质子数相同中子数不同,为同位素,故B正确;
C.原子结构中质量数不同,质子数相同,化学性质相同,物理性质不同,故C错误;
D.原子中质子数相同,核外电子数相同都是6,故D错误;
故选B.
点评 本题考查了原子结构、微粒关系、概念实质的理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.绿色能源是指使用时不会对环境造成污染的能源.下列属于绿色能源的是( )
①太阳能②风能③石油④煤⑤木材⑥潮汐能.
①太阳能②风能③石油④煤⑤木材⑥潮汐能.
| A. | ①②③ | B. | ③④ | C. | ④ | D. | ①②⑥ |
13. 能源、环境与生产生活和社会发展密切相关.
能源、环境与生产生活和社会发展密切相关.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如下:
①cl= c2(填“>”、“<”或“=”),a=19.6;
②该温度下反应的平衡常数K=$\frac{25}{12}$L2•mol-2;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
③其他条件不变,达到平衡后,下列不能提高H2转化率的操作是a bd(填字母编号).
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
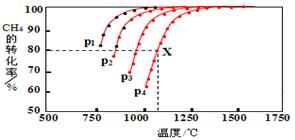
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图.据图可知,p1、p2、p3、p4由大到小的顺序P4>P3>P2>P1.
(3)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为1.60NA,阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.
 能源、环境与生产生活和社会发展密切相关.
能源、环境与生产生活和社会发展密切相关.(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如下:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO 2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②该温度下反应的平衡常数K=$\frac{25}{12}$L2•mol-2;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
③其他条件不变,达到平衡后,下列不能提高H2转化率的操作是a bd(填字母编号).
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图.据图可知,p1、p2、p3、p4由大到小的顺序P4>P3>P2>P1.
(3)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为1.60NA,阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.
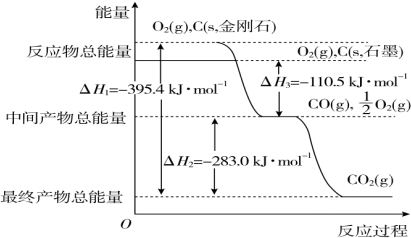
10. 合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.
合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.
(一)煤化工生产中生产合成气的反应为:C(s)+H20(g)?C0(g)+H2(g)△H1
已知:C(s)+$\frac{1}{2}$O2(g)=C0(g)△H2=-110.5kJ•mol-1
H2(g)+$\frac{1}{2}$02(g)=H20(g)△H3=-242kJ•mol-1
(1 )反应C(s)+H20(g)?C0(g)+H2(g)在高温(填高温或低温)下自发进行,理由是△H1=△H2-△H3=131.5kJ>0,△S>0.
(2)在恒温恒容下,同时放入C(s)、H20(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H20(g)?C0(g)+H2(g))已达到平衡的是ACD.
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH-0键断裂的同时有1molH-H键断裂
D.混合气体的平均相对分子质量为18且保持不变
(二)天然气化工中生产合成气的主要反应为:
2CH4(g)+02(g)?2C0(g)+4H2(g)△H=-23kJ•mol-1
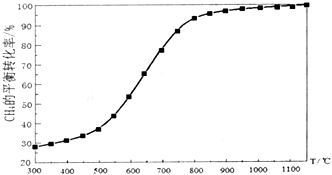
在恒容容器中按物质的量之比1:2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
(3)图中所表示的CH4的平衡转化率随温度变化的曲线,实质上是多个反应共同作用的结果.与之相关的反应还有以下三个反应:
I.CH4(g)+2O2(g)?C02(g)+2H20(g)△H5=-802kJ•mol-1
Ⅱ.CH4(g)+H2O(g)?C0(g)+3H2(g)△H6=+201kJ•mol-1
Ⅲ.CO(g)+H2O(g)?CO2(g)+H2(g)△H7=-35kJ•mol-1
你认为上述反应中,在高温下占主导地位的是Ⅱ(填反应序号).
(4)根据平衡移动原理,请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线.
(5)工业上常用选择性来判断不同反应条件下目标产物的产率,即:选择性=$\frac{目标产物的产率}{反应原料的转化率}$,现有实验测得反应2CH4(g)+02(g)?2CO(g)+4H2(g)在750℃下,以不同碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示:
最佳碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$]为1:0.5.假设按碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$]=l:1投料,反应容器的体积为VL,通入CH4和02各amol,请列式表示平衡时容器内C0的浓度(用a、V的代数式表示)$\frac{a×0.98×0.65}{V}$mol/L.
 合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.
合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.(一)煤化工生产中生产合成气的反应为:C(s)+H20(g)?C0(g)+H2(g)△H1
已知:C(s)+$\frac{1}{2}$O2(g)=C0(g)△H2=-110.5kJ•mol-1
H2(g)+$\frac{1}{2}$02(g)=H20(g)△H3=-242kJ•mol-1
(1 )反应C(s)+H20(g)?C0(g)+H2(g)在高温(填高温或低温)下自发进行,理由是△H1=△H2-△H3=131.5kJ>0,△S>0.
(2)在恒温恒容下,同时放入C(s)、H20(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H20(g)?C0(g)+H2(g))已达到平衡的是ACD.
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH-0键断裂的同时有1molH-H键断裂
D.混合气体的平均相对分子质量为18且保持不变
(二)天然气化工中生产合成气的主要反应为:
2CH4(g)+02(g)?2C0(g)+4H2(g)△H=-23kJ•mol-1
在恒容容器中按物质的量之比1:2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
(3)图中所表示的CH4的平衡转化率随温度变化的曲线,实质上是多个反应共同作用的结果.与之相关的反应还有以下三个反应:
I.CH4(g)+2O2(g)?C02(g)+2H20(g)△H5=-802kJ•mol-1
Ⅱ.CH4(g)+H2O(g)?C0(g)+3H2(g)△H6=+201kJ•mol-1
Ⅲ.CO(g)+H2O(g)?CO2(g)+H2(g)△H7=-35kJ•mol-1
你认为上述反应中,在高温下占主导地位的是Ⅱ(填反应序号).
(4)根据平衡移动原理,请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线.
(5)工业上常用选择性来判断不同反应条件下目标产物的产率,即:选择性=$\frac{目标产物的产率}{反应原料的转化率}$,现有实验测得反应2CH4(g)+02(g)?2CO(g)+4H2(g)在750℃下,以不同碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示:
| 碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$] | 1:0.25 | 1:0.5 | 1:1 | 1:1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
7.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的△H<0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.,则6s时c(A)=0.022 mol•L-1,
n(C)=0.09mol;若反应经一段时间后,达到平衡后,如果这时再向该密闭容器中再充入1mol氩气,平衡时A的转化率α(A)=80%;
(3)判断该反应是否达到平衡的依据为c:
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的k=2.5.
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的△H<0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.,则6s时c(A)=0.022 mol•L-1,
n(C)=0.09mol;若反应经一段时间后,达到平衡后,如果这时再向该密闭容器中再充入1mol氩气,平衡时A的转化率α(A)=80%;
(3)判断该反应是否达到平衡的依据为c:
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的k=2.5.
14.已知KSP(Ag2CrO4)=1.12×10-12,将等体积的4×10-3mo1•L-1的AgNO3和4×10-3mo1•L-1K2CrO4混合,能产生Ag2CrO4沉淀(填“能”或“不能”).
11.在温度、容积相同的 3 个密闭容器中,按不同方式 投入反应物,保持恒温、恒容,测 得反应达到平衡时的有关数据如表(已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1)
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A. | α1+α3<1 | B. | a+b>92.4 | C. | 2p2<p3 | D. | 2c1>c3 |
12.在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$.已知:K300℃>K350℃,则该反应是放热反应.
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol/(L•s).
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol/(L•s).
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.