题目内容
10.10.8g某有机物A在纯氧中完全燃烧,仅生成二氧化碳30.8g,水7.2g,经过测定此有机物A相对分子质量为108.(1)求此有机物A的分子式.
(2)若此有机物A跟FeCl3溶液作用显紫色,且有机物A与溴水反应,1mol 有机物A消耗3mol溴单质,写出此有机物A的结构简式以及A与溴水反应的化学方程式.
分析 (1)根据n=$\frac{m}{M}$分别计算出二氧化碳30.8g,水7.2g的物质的量,然后根据C、H元素总质量确定O原子的存在情况,最后利用质量守恒定律确定A的分子式;
(2)此有机物A跟FeCl3溶液作用显紫色,则A分子中含有酚羟基,再结合1mol 有机物A消耗3mol溴单质判断其结构简式,最后写出A与溴水反应的化学方程式.
解答 解:(1)7.2gH2O中H原子的物质的量为:$\frac{7.2g}{18g/mol}$×2=0.8mol,标况下30.8g CO2的物质的量为:$\frac{30.8g}{44g/mol}$=0.7mol,则n(C)=0.7mol,
10.8g有机物中含有C、H元素的总质量为:m(C)+m(H)=0.7mol×12g/mol+0.8mol×1g/mol=9.2g,故10.8g有机物中m(O)=10.8g-9.2g=1.6gg,则n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
所以n(C):n(H):n(O)=0.7mol:0.8mol:0.1mol=7:8:1,该有机物的最简式为C7H8O,分子式为(C7H8O)n,又因相对分子质量为108,即108n=108,解得:n=1,所以该有机物的分子式为:C7H8O,
答:有机物A的分子式为C7H8O;
(2)若此有机物A跟FeCl3溶液作用显紫色,则A分子中含有酚羟基,可能的结构简式有: 、
、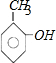 、
、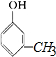 ,且有机物A与溴水反应,1mol 有机物A消耗3mol溴单质,则满足体积的只有
,且有机物A与溴水反应,1mol 有机物A消耗3mol溴单质,则满足体积的只有 ,
, 与溴水反应的化学方程式为:
与溴水反应的化学方程式为: +3Br2→3HBr+
+3Br2→3HBr+ ,
,
答:有机物A的结构简式为 ,
, 与溴水反应的化学方程式为
与溴水反应的化学方程式为 +3Br2→3HBr+
+3Br2→3HBr+ .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握守恒思想在确定有机物分子式中的应用方法,试题培养了学生的化学计算能力.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | 稀醋酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则可知C的燃烧热为11.5KJ/mol |
①Al
②Al2O3
③Al(OH)3
④Na2CO3溶液
⑤Ca(HCO3)2溶液
⑥KHSO4溶液.
| A. | ①②③⑥ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子 | |
| C. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
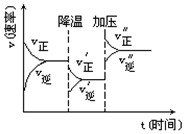 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 降温后逆反应速率增大 | B. | 逆反应是放热反应 | ||
| C. | A、B、C、D均为气体 | D. | 若A、B是气体,则D是液体或固体 |
| A. | 烧碱、液态氧、碘酒 | B. | 干冰、铁、冰水混合物 | ||
| C. | 生石灰、白磷、熟石灰 | D. | 碱石灰、氮气、胆矾 |
①太阳能②风能③石油④煤⑤木材⑥潮汐能.
| A. | ①②③ | B. | ③④ | C. | ④ | D. | ①②⑥ |
 能源、环境与生产生活和社会发展密切相关.
能源、环境与生产生活和社会发展密切相关.(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如下:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO 2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②该温度下反应的平衡常数K=$\frac{25}{12}$L2•mol-2;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
③其他条件不变,达到平衡后,下列不能提高H2转化率的操作是a bd(填字母编号).
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
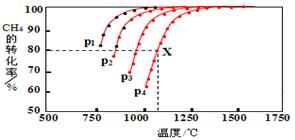
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图.据图可知,p1、p2、p3、p4由大到小的顺序P4>P3>P2>P1.
(3)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为1.60NA,阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.