题目内容
5. 苯乙烯(
苯乙烯(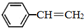 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△=-Q1kJ.mol-1
=CH2(g)+H2(g)△=-Q1kJ.mol-1(1)苯乙烯可聚合生成聚苯乙烯,该聚合物的结构简式为
 .
.(2)已知
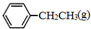 、
、 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.(3)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a<b(填“>”、“<”或“=”),乙苯的转化率将减小(填“增大”、“减小”或“不变”).
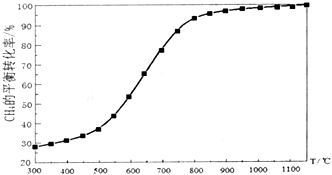
(4)在实际生产中,常保持总压0.1Mpa不变,并向反应体系加入稀释剂,如CO2、N2等.反应混合气物质的量之比及反应温度与乙苯(EB)脱氢转化率关系(N2不参与反应)如图所示.
①由图判断Q>0(填“>”或“<”),依据是随着温度升高,乙苯的平衡转化率增大.
②A、B两点对应的正反应速率较大的是B.
③A点乙苯的转化率比B点高,原因是保持总压不变,充入N2,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大.
④用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数.则600℃时的平衡常数Kp=0.019MPa.(保留两位小数)
分析 (1)苯乙烯可聚合生成聚苯乙烯是加成聚合生成聚苯乙烯;
(2)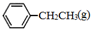 、
、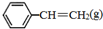 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,则
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,则
①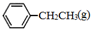 +$\frac{21}{2}$O2(g)→8CO2(g)+5H2O(l)△H=-Q1 kJ•mol-1,
+$\frac{21}{2}$O2(g)→8CO2(g)+5H2O(l)△H=-Q1 kJ•mol-1,
②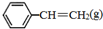 +10O2(g)→8CO2(g)+4H2O(l)△H=-Q2 kJ•mol-1,
+10O2(g)→8CO2(g)+4H2O(l)△H=-Q2 kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)→2H2O(l)△H=-Q3 kJ•mol-1,
由盖斯定律可知,①-②-③得到 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$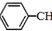 =CH2(g)+H2(g);
=CH2(g)+H2(g);
(3)恒容密闭容器中,物质的量与压强成正比,增大压强平衡逆向移动;
(4)①由图可知,温度越高转化率越大;
②A、B温度相同,乙苯的浓度越大,反应速率越快;
③A点乙苯的转化率比B点高,与充入N2,容器体积增大,平衡正向移动有关;
④ CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)
=CH2(g)+H2(g)
开始 a 0 0
转化 0.4a 0.4a 0.4a
平衡 0.6a 0.4a 0.4a
分压=总压×物质的量分数,则分压分别为0.1Mpa×$\frac{3}{7}$、0.1Mpa×$\frac{2}{7}$、0.1Mpa×$\frac{2}{7}$
Kp=0.1$\frac{0.1Mpa×\frac{2}{7}×0.1Mpa×\frac{2}{7}}{0.1Mpa×\frac{3}{7}}$,以此来解答.
解答 解:(1)苯乙烯可聚合生成聚苯乙烯是加成聚合生成聚苯乙烯;结构简式为: ,故答案为:
,故答案为: ;
;
(2)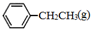 、
、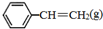 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,则
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,则
①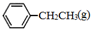 +$\frac{21}{2}$O2(g)→8CO2(g)+5H2O(l)△H=-Q1 kJ•mol-1,
+$\frac{21}{2}$O2(g)→8CO2(g)+5H2O(l)△H=-Q1 kJ•mol-1,
②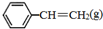 +10O2(g)→8CO2(g)+4H2O(l)△H=-Q2 kJ•mol-1,
+10O2(g)→8CO2(g)+4H2O(l)△H=-Q2 kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)→2H2O(l)△H=-Q3 kJ•mol-1,
由盖斯定律可知,①-②-③得到 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g);
=CH2(g)+H2(g);
则(-Q1 kJ•mol-1)-(-Q2 kJ•mol-1)-(-Q3 kJ•mol-1)=+Q kJ•mol-1,即Q=Q2+Q3-Q1,
故答案为:Q2+Q3-Q1;
(3)恒容密闭容器中,物质的量与压强成正比,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a<b;增大压强平衡逆向移动,乙苯的转化率将减小;
故答案为:<;减小;
(4)①由图可知,温度越高转化率越大,则升高温度,平衡正向移动,Q>0,
故答案为:>;随着温度升高,乙苯的平衡转化率增大;
②A、B温度相同,B点乙苯的浓度大,则B点反应速率大,
故答案为:B;
③A点乙苯的转化率比B点高,原因是保持总压不变,充入N2,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大,
故答案为:保持总压不变,充入N2,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大;
④ CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)
=CH2(g)+H2(g)
开始 a 0 0
转化 0.4a 0.4a 0.4a
平衡 0.6a 0.4a 0.4a
分压=总压×物质的量分数,则分压分别为0.1Mpa×$\frac{3}{7}$、0.1Mpa×$\frac{2}{7}$、0.1Mpa×$\frac{2}{7}$
Kp=$\frac{0.1Mpa×\frac{2}{7}×0.1Mpa×\frac{2}{7}}{0.1Mpa×\frac{3}{7}}$=0.019MPa,
故答案为:0.019MPa.
点评 本题考查化学平衡计算及平衡移动,为高频考点,把握Kp的计算、化学平衡移动的影响为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 烧碱、液态氧、碘酒 | B. | 干冰、铁、冰水混合物 | ||
| C. | 生石灰、白磷、熟石灰 | D. | 碱石灰、氮气、胆矾 |
CrO42-$→_{①转化}^{H+}$Cr2O72-$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)═Cr2O72-(aq)+H2O(l).转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
 能源、环境与生产生活和社会发展密切相关.
能源、环境与生产生活和社会发展密切相关.(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.相关数据如下:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO 2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②该温度下反应的平衡常数K=$\frac{25}{12}$L2•mol-2;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=0.09mol•L-1•s-1.
③其他条件不变,达到平衡后,下列不能提高H2转化率的操作是a bd(填字母编号).
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图.据图可知,p1、p2、p3、p4由大到小的顺序P4>P3>P2>P1.
(3)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为1.60NA,阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.
 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
| 容器 | 温度/℃ | 起始物质的量/mol | |
| NO(g) | CO(g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 该反应的正反应为吸热反应 | |
| B. | 达到平衡时,乙中CO2的体积分数比甲中的小 | |
| C. | T1℃时,若起始时向甲中充入0.40molNO、0.40molCO、0.40molN2和0.40molCO2,则反应达到新平衡前v(正)<v(逆) | |
| D. | T2℃时,若起始时向丙中充入0.06molN2和0.12molCO2,则达平衡时N2的转化率大于40% |
 合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.
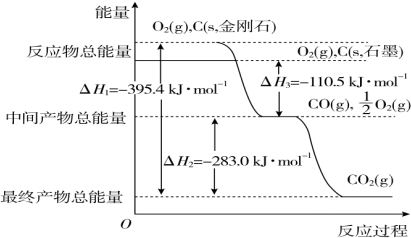
合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.(一)煤化工生产中生产合成气的反应为:C(s)+H20(g)?C0(g)+H2(g)△H1
已知:C(s)+$\frac{1}{2}$O2(g)=C0(g)△H2=-110.5kJ•mol-1
H2(g)+$\frac{1}{2}$02(g)=H20(g)△H3=-242kJ•mol-1
(1 )反应C(s)+H20(g)?C0(g)+H2(g)在高温(填高温或低温)下自发进行,理由是△H1=△H2-△H3=131.5kJ>0,△S>0.
(2)在恒温恒容下,同时放入C(s)、H20(g)、CO(g)、H2(g)四种物质,下列事实能够说明反应C(s)+H20(g)?C0(g)+H2(g))已达到平衡的是ACD.
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有2molH-0键断裂的同时有1molH-H键断裂
D.混合气体的平均相对分子质量为18且保持不变
(二)天然气化工中生产合成气的主要反应为:
2CH4(g)+02(g)?2C0(g)+4H2(g)△H=-23kJ•mol-1
在恒容容器中按物质的量之比1:2加入一定量的CH4和O2,在压强为1.01×105Pa、不同温度下测得CH4的平衡转化率如图所示:
(3)图中所表示的CH4的平衡转化率随温度变化的曲线,实质上是多个反应共同作用的结果.与之相关的反应还有以下三个反应:
I.CH4(g)+2O2(g)?C02(g)+2H20(g)△H5=-802kJ•mol-1
Ⅱ.CH4(g)+H2O(g)?C0(g)+3H2(g)△H6=+201kJ•mol-1
Ⅲ.CO(g)+H2O(g)?CO2(g)+H2(g)△H7=-35kJ•mol-1
你认为上述反应中,在高温下占主导地位的是Ⅱ(填反应序号).
(4)根据平衡移动原理,请在图中画出压强为5.05×105Pa时CH4的平衡转化率随温度的变化曲线.
(5)工业上常用选择性来判断不同反应条件下目标产物的产率,即:选择性=$\frac{目标产物的产率}{反应原料的转化率}$,现有实验测得反应2CH4(g)+02(g)?2CO(g)+4H2(g)在750℃下,以不同碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$]投料时反应达平衡后CH4的转化率及H2、CO的选择性,所测数据如表所示:
| 碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$] | 1:0.25 | 1:0.5 | 1:1 | 1:1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |