题目内容
8.某工程技术人员在检测维修高铁时发现,某段铁轨大面积锈蚀,周围大面积森林枯萎.经调查发现附近有一个水泥厂,生产水泥原料是煤矸石,煅烧煤矸石产生二氧化硫污染空气形成酸雨造成的.政府部门为了我国国民的人身安全果断关闭水泥厂.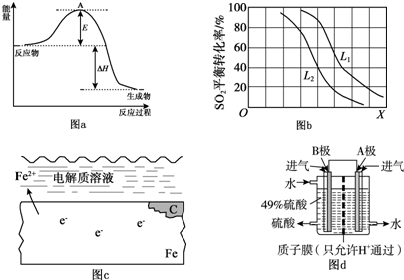
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O
 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
2H2SO4.(2)已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
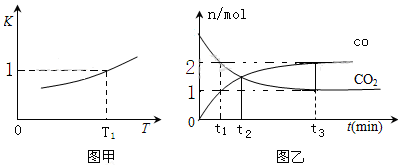
2SO2+O2 $\stackrel{催化剂}{?}$2SO3 反应过程的能量变化如图a所示.
①图a中△H=-198kJ/mol;该反应通常用V2O5作催化剂,加V2O5会使图a中A点降低,理由是因为催化剂改变了反应历程,使活化能E降低.
②L(L1、L2)、X可分别代表压强或温度.图b表示L一定时,SO2(g)的平衡转化率随X的变化关系.
a. X代表的物理量是温度.
b.判断L1、L2的大小关系,并简述理由:L1>L2,2SO2+O2
 2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.
2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.(3)钢铁锈蚀图示如图c所示:
①用箭头画出图c中电子的运动方向
②请你分析高铁铁轨锈蚀的原因是Fe-2e-=Fe2+;由于电解质溶液中有H2CO3溶液,电离出氢离子,2H++2e-=
H2↑发生析氢腐蚀.电解质中又溶于氧气,O2+4e-+2H2O=4OH-,发生吸氧腐蚀.
(4)我国的科技人员为了消除SO2的污染,利用原电池原理,变废为宝,设计由SO2和O2
来制备硫酸,设计装置如图d所示,电极A、B为多孔的材料.
①A极为正极(填“正极”或“负极”).
②B极的电极反应式是SO2+2H2O-2e-═SO42-+4H+.
分析 (1)SO2形成硫酸型酸雨的反应为:SO2+H2O H2SO3 2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4;
H2SO3 2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4;
(2)①根据参加反应SO2的物质的量之比等于对应的△H之比;催化剂能够降低反应的活化能;
②该反应为气体体积减小的反应,如果增大压强,转化率大,反应是放热反应,升温平衡逆向进行,二氧化硫转化率减小,据此判断;
(3)①钢铁腐蚀铁作负极失去电子,C作正极;
②铁作负极失电子变亚铁离子,溶液中氢离子和溶解的氧气得电子,形成原电池;
(4))①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极;
②B极上的电极反应二氧化硫失电子和水反应生成硫酸根离子和氢离子.
解答 解:(1)SO2形成硫酸型酸雨的反应为:SO2+H2O H2SO3 2H2SO3+O2
H2SO3 2H2SO3+O2 2H2SO4;
2H2SO4;
故答案为:SO2+H2O H2SO3 2H2SO3+O2
H2SO3 2H2SO3+O2 2H2SO4;
2H2SO4;
(或2SO2+O2  2SO3SO3+H2O=H2SO4 )
2SO3SO3+H2O=H2SO4 )
(2)①因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1;催化剂能够降低反应的活化能;
故答案为:-198;因为催化剂改变了反应历程,使活化能E降低;
②a.由图可知,X越大,转化率越低,该反应正反应为气体体积减小的反应,如果增大压强,二氧化碳的转化率大,所以X表示温度;
故答案为:温度;
b.温度升高,转化率下降,平衡逆向移动,增大压强,转化率大,所以L1>L2;
故答案为:L1>L2;2SO2+O2  2SO3反应的△H=-198 kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小;
2SO3反应的△H=-198 kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小;
(3)①钢铁的腐蚀,铁作负极失去电子给正极的C,电子转移方向为:
故答案为:
②Fe-2e-=Fe2+; 由于电解质溶液中有H2CO3溶液,电离出氢离子,2H++2e-=
H2↑发生析氢腐蚀.电解质中又溶于氧气,O2+4e-+2H2O=4OH-,发生吸氧腐蚀;
故答案为:Fe-2e-=Fe2+; 由于电解质溶液中有H2CO3溶液,电离出氢离子,2H++2e-=
H2↑发生析氢腐蚀.电解质中又溶于氧气,O2+4e-+2H2O=4OH-,发生吸氧腐蚀;
(4)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极;
故答案为:正极;
②分析可知B极上的电极反应式为:SO2+2H2O-2e-═SO42-+4H+;
故答案为:SO2+2H2O-2e-═SO42-+4H+.
点评 本题考查反应能量变化、化学平衡常数及平衡状态的判断、氧化还原反应及识金属的腐蚀,涉及的题量较大,综合性强,题目难度中等.

| A. | 氢氧化铜和稀盐酸 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 澄清的石灰水和稀硝酸反应 | D. | 醋酸和氢氧化钠反应 |
| A. | 水、氢氧化钾溶液、稀盐酸 | B. | 水、氢氧化钠溶液、稀盐酸? | ||
| C. | 水、硝酸银溶液、稀硝酸 | D. | 水、氢氧化钾溶液、稀硝酸? |
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为
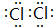 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.

 工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则
工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则