题目内容
19.下列反应能用H++OH-=H2O表示的是( )| A. | 氢氧化铜和稀盐酸 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 澄清的石灰水和稀硝酸反应 | D. | 醋酸和氢氧化钠反应 |
分析 离子方程式H++OH-=H2O表示强酸与强碱反应生成可溶性盐和水的一类反应,注意酸不能为醋酸,碱不能为氢氧化铜、氢氧化镁等弱碱,生成的盐必须是可溶性的,不能为硫酸钡,据此进行解答.
解答 解:A.氢氧化铜为弱碱,在离子反应中应该写成化学式,不能用离子方程式H++OH═H2O表示,故A错误;
B.Ba(OH)2溶液滴入稀硫酸中,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,不能用离子方程式H++OH═H2O表示,故B错误;
C.澄清的石灰水中的氢氧化钙需要拆开,二者反应的离子方程式为:H++OH═H2O,故C正确;
D.醋酸属于弱电解质,离子方程式中写成分子式,不能用离子方程式H++OH═H2O表示,故D错误;
故选C.
点评 本题考查酸碱中和的离子反应,为高频考点,侧重离子反应中保留化学式的物质的考查,注意物质的溶解性和酸、碱的强弱即可解答,题目难度不大

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
9.氨基甲酸铵(NH2COONH4)是一种用途广泛的化工原料,其制备原理为:2NH3(g)+C02(g)?NH2C00NH4(s).实验室可用如图1所示装置制备: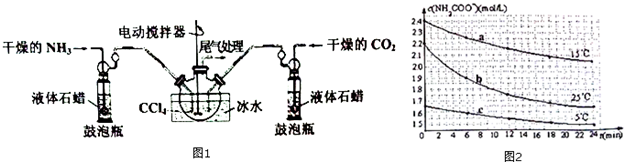
请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
30.0℃时该反应平衡常数K的计算式为$\frac{1}{(\frac{2}{3}×4.8×1{0}^{-3})^{2}×(\frac{1}{3}×4.8×1{0}^{-3})}$(不必计算结果)
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.

请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
| 温度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡时气体总浓度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.
10.下列分离提纯所选用的试剂正确的是( )
| A. | 除去O2中混有的N2:选用灼热的铜网 | |
| B. | 提取碘水中的碘单质:选用有机试剂苯 | |
| C. | 除去CO2中混有的CO:选用适量澄清石灰水 | |
| D. | 除去Mg粉中混有的MgO:选用过量稀盐酸 |
14.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 向水中通入二氧化硫气 | ||
| C. | 将水加热煮沸 | D. | 向水中加硫酸钠晶体 |
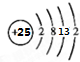 ,其最高正价为+7;是第四周期ⅦB族.
,其最高正价为+7;是第四周期ⅦB族.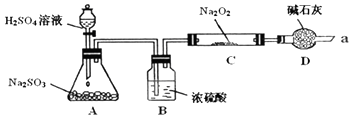
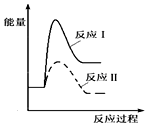
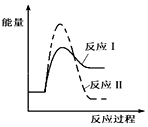
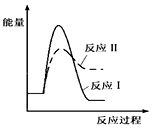
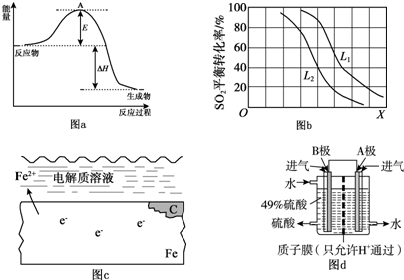
 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
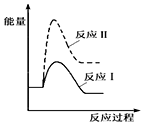
2H2SO4. 2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.
2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.